上海市重大传染病和生物安全研究院团队在γ型疱疹病毒疫苗研发中取得进展
以Epstein-Barr病毒(EBV)为代表的人γ型疱疹病毒是一组对人类健康造成巨大威胁的重要病原体。其中,EBV在人群中的感染率超过90%,可导致传染性单核细胞增多症、淋巴瘤、胃癌和鼻咽癌等疾病。但至今尚无针对EBV或其它人类γ型疱疹病毒的有效疫苗。EBV主要通过唾液和亲密接触进行传播,首先在上皮细胞建立感染和复制,随后靶向性感染B细胞并长期潜伏,在特定条件下重新激活。人类是EBV的唯一天然宿主。缺乏能够支持EBV感染全过程的小动物模型严重阻碍了EBV疫苗研发和评价。而鼠γ疱疹病毒68 (MHV-68) 与EBV在基因组结构和功能元件上高度相似,并且能够在小鼠中完成黏膜感染和B细胞潜伏,从而模拟EBV的自然感染和潜伏过程。因此,MHV68可作为EBV的替代模型,用于评价疫苗策略的有效性。
2025年8月4日,上海市重大传染病和生物安全研究院黄忠研究员团队、中国科学院梁小珍研究员团队和复旦大学附属华山医院感染科李宁教授团队共同在国际学术期刊Vaccines 上发表题为“A Bivalent mRNA Vaccine Efficiently Prevents Gammaherpesvirus Latent Infection”的研究论文,该论文报道了针对MHV68的mRNA候选疫苗的制备、免疫原性和保护效力,并初步探索了候选疫苗的保护作用机制。

研究人员以MHV68结构蛋白中包含中和抗体表位的gH、gL和gB蛋白为靶点,设计并构建了两种mRNA疫苗:一种表达gH与gL的融合蛋白(gHgL-mRNA),另一种表达gB蛋白(gB-mRNA)。研究人员将体外合成的两种mRNA分别转染HEK293T细胞,随后检测目标蛋白的表达情况。结果显示(图1),gHgL表达量较高而gB表达量相对较低。用内切糖苷酶PNGase F处理后,这两种蛋白的分子量显著降低,提示它们具有糖基化修饰。这些结果表明,两种mRNA候选疫苗均能正确表达目标蛋白。
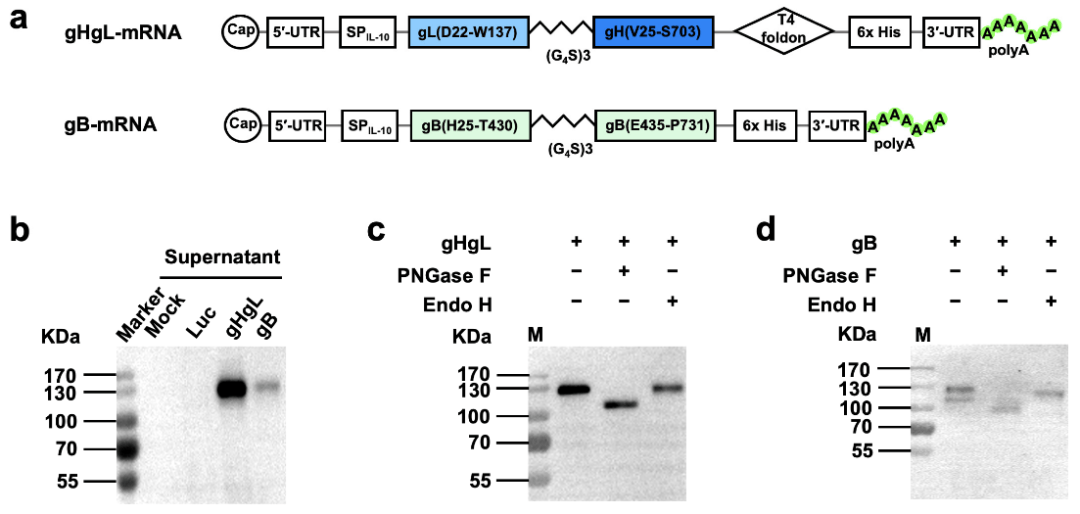 图1 mRNA疫苗载体的构建和表达分析
图1 mRNA疫苗载体的构建和表达分析
研究人员首先在C57BL/6J小鼠模型中评估了单价的gHgL-mRNA或gB-mRNA候选疫苗的免疫原性和抗病毒保护效力。分别将gHgL-mRNA和gB-mRNA与脂质纳米颗粒(LNP)混合,制备出候选疫苗,在第0,3,6和16周免疫小鼠,在第19周鼻腔接种MHV68病毒,其间采集血液和脾脏样品进行分析。结果显示,gHgL-mRNA免疫组小鼠能够产生高滴度的血清中和抗体,并且33%的小鼠在病毒攻击后未产生脾脏B细胞潜伏感染,表明靶向gHgL的中和抗体在体内保护中发挥关键作用;同时,gB-mRNA免疫小鼠未产生中和抗体,却具有一定程度的抗病毒保护作用,提示了不依赖于中和抗体的保护机制。
研究人员随后评估了单价gHgL-mRNA或gB-mRNA疫苗所诱导的细胞免疫反应。单价疫苗免疫小鼠两次后,采集小鼠脾脏用于ELISPOT和流式分析。结果显示,两种疫苗均能有效诱导抗原特异性的T细胞反应。其中,gB-mRNA免疫小鼠产生高比例的gB特异性的IFN-γ阳性CD8⁺ T细胞,提示所观察到的gB-mRNA疫苗保护作用可能是由gB特异性CD8⁺ T细胞所提供。
在明确单个gHgL-mRNA和gB-mRNA疫苗的免疫保护效应后,研究人员进一步评估二者联合免疫是否具有协同增效作用。研究人员将gHgL-mRNA与gB-mRNA按1:1比例混合,制备成双价mRNA疫苗(gHgL/gB-mRNA),并与各单价疫苗在小鼠免疫-感染实验中进行平行比较。结果显示(图2),双价gHgL/gB-mRNA疫苗在诱导中和抗体方面与单价gHgL-mRNA无显著差异,但在阻断MHV68潜伏感染上要优于各单价疫苗,使50%的小鼠免于MHV68的脾脏潜伏感染。
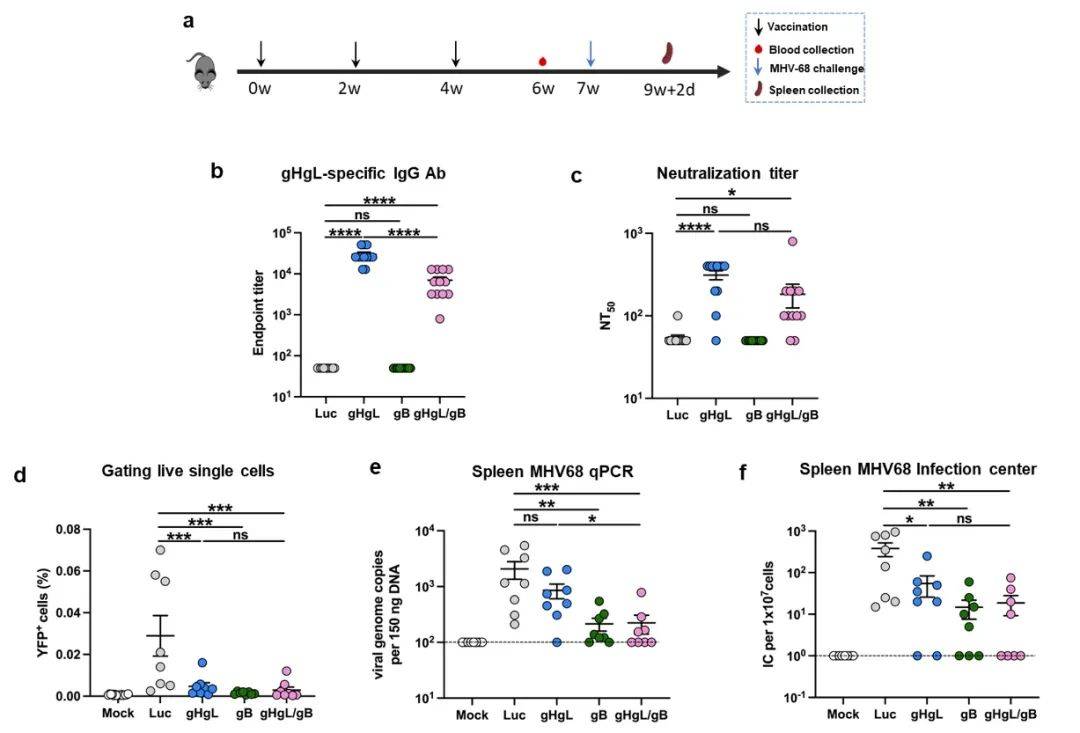 图2 双价mRNA疫苗的免疫原性和保护效力
图2 双价mRNA疫苗的免疫原性和保护效力
综上所述,该研究以MHV68为模型,首次明确了基于mRNA平台的非复制型亚单位疫苗能够有效阻断γ型疱疹病毒的自然感染和潜伏,为设计和开发针对EBV及其它人类γ型疱疹病毒的疫苗提供了重要信息。
上海市重大传染病和生物安全研究院黄忠研究员、中国科学院梁小珍研究员和复旦大学附属华山医院感染科李宁教授为该论文的共同通讯作者。中国科学院博士生尹燕楠和上海市重大传染病和生物安全研究院臧金凯博士为该论文的共同第一作者。 该研究得到了上海市“重大突发传染病防控关键核心技术研究”市级科技重大专项、国家重点研发计划的经费支持。
来源:Vaccine前研公众号; 上海重大传染病和生物安全研究院

