邹冬玲团队用卵巢癌类器官预测药效,准确率达 91.7%

卵巢癌是女性最致命的妇科恶性肿瘤之一,具有高度异质性和显著的治疗反应差异。
重庆大学附属肿瘤医院妇科肿瘤中心邹冬玲团队基于患者来源类器官(PDO)技术,构建了覆盖多病理亚型的卵巢癌类器官资源库,并系统验证了其在预测一线化疗和PARP抑制剂(PARPi)疗效中的临床相关性。
研究首次实现了类器官药物反应与患者真实疗效的功能对应,为卵巢癌个体化精准治疗提供了新的策略与实验依据。
文章介绍

题目:来源于患者的类器官可预测晚期卵巢癌对化疗和PARP抑制剂的反应
英文题目:Patient-derived organoids predict responses to chemotherapy and PARP inhibitors in advanced ovarian cancer
杂志:Journal of Translational Medicine
影响因子:7.5
PMID:41491716
发表时间:2026年1月
Part.01
研究背景
上皮性卵巢癌(EOC)是死亡率最高的女性生殖系统肿瘤,五年生存率长期徘徊在30%左右。尽管PARPi的应用显著改善了部分患者的疗效,但仅依赖BRCA或HRD等基因指标仍难以准确预测临床反应。
为此,建立能真实反映患者肿瘤特征的体外功能模型,对指导个体化治疗至关重要。
近年来,PDO因能在体外重现肿瘤的组织学和分子特征,被视为连接基础研究与临床转化的理想模型。
多项研究表明,类器官可有效模拟肿瘤生物学特征并预测临床疗效,为个体化用药决策提供了新的研究与转化平台。
Part.02
研究方法
本研究纳入30例初治EOC患者的原发灶组织,用于建立EOC类器官模型。通过优化培养体系,共建立21株类器官。
对获得的类器官进行H&E染色、免疫组化(IHC)及全外显子测序(WES)分析,以比较其与对应原发肿瘤在组织学及分子水平上的一致性。
随后,开展化疗药物(卡铂、紫杉醇)及PARP抑制剂(奥拉帕利、尼拉帕利)的药物敏感性检测(DST),并同步收集患者一线化疗及PARPi维持治疗的临床疗效资料及BRCA/HRD状态。
最后,以患者临床结局为参照,采用灵敏度、特异度、准确度、AUC值及Cohen’s κ系数等统计学指标,对PDO-DST的预测性能进行系统评价。
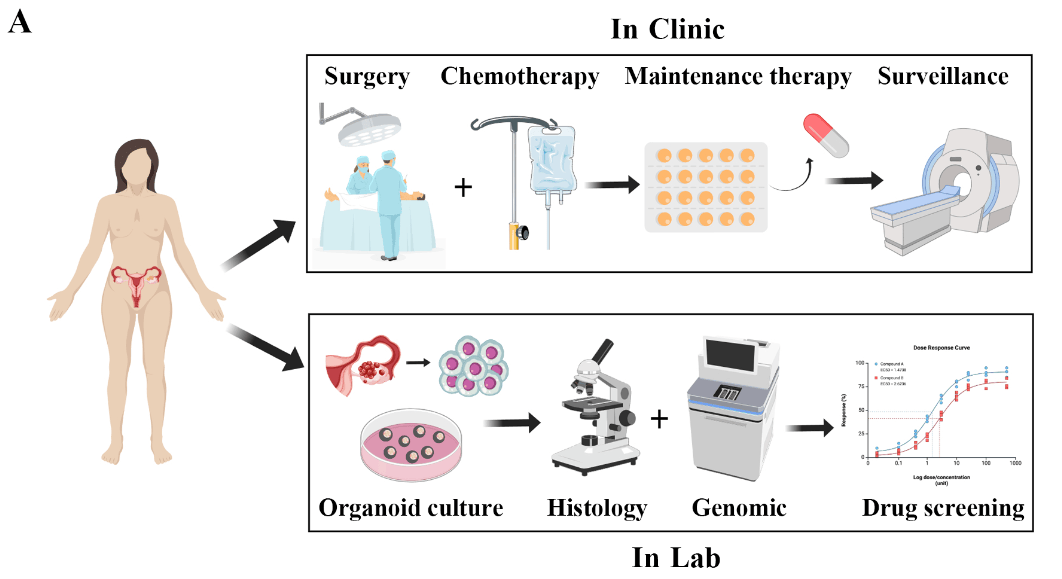
△ 研究流程的示意图
Part.03
关键结果
1、患者来源卵巢癌类器官系的建立
通过手术切除或活检获得30例初治EOC患者原发肿瘤组织,经病理确诊后开展三维类器官培养。
样本涵盖多种组织学亚型,包括22例高级别浆液型(HGSOC)、3例低级别浆液型(LGSOC)、2例子宫内膜样(ENOC)、2例黏液型(MOC)及1例透明细胞型(CCOC)。
最终成功建立21株患者来源类器官,成功率达70%。类器官形态多样,呈现与原发肿瘤一致的囊性、实性或囊实混合结构,中性红染色显示其活性良好。
此外,研究团队还建立了卵巢肉瘤及小细胞癌类器官,进一步丰富了模型谱系。

△ 不同类型卵巢癌类器官的代表性明场图像
2、类器官忠实重现原发肿瘤的病理形态与免疫表型特征
研究团队通过盲法HE染色比对发现,卵巢癌类器官(EOC-PDO)在组织学层面高度保留了原发肿瘤特征。
高级别浆液型类器官呈明显核异质性和致密染色质,低级别浆液型类器官保持规则单层上皮结构,子宫内膜样类器官形成腺体样和筛状结构,黏液型类器官呈球状、极性清晰并伴胞质空泡和分泌物,均与原组织形态一致。
免疫组化结果进一步显示,浆液型类器官持续表达PAX8和TP53,子宫内膜样类器官对ER和PR阳性,黏液型类器官保留CDX2和CK20表达。
整体结果表明,EOC-PDO在形态与免疫表型上均忠实再现原发肿瘤特征,既保持个体同源性,又反映生物学异质性,为后续基因组和药物功能研究奠定基础。
3、类器官在基因组水平高度重现原发肿瘤分子特征
在组织学与免疫表型一致性验证的基础上,研究团队对12株卵巢癌类器官(11株高级别浆液型、1株子宫内膜样)及其配对肿瘤组织进行了WES分析。
结果显示,类器官与原发肿瘤的基因突变谱高度一致,卵巢癌常见驱动突变如TP53(10/11,90.9%)及PTEN均在类器官中得到保留。碱基替换模式与突变分布也与原组织相符。
总体突变分析显示,约79%的单核苷酸变异(SNV)为共同突变,组织特异性与类器官特异性突变分别占7.5%和13.5%。
两者的肿瘤突变负荷(TMB)无显著差异(p=0.506),且呈高度正相关(r=0.9967,p<0.001)。
4、类器官药敏检测精准预测卵巢癌化疗反应
研究团队利用20例EOC-PDO开展卡铂/紫杉醇药敏测试,并将体外药物反应结果与患者的真实临床疗效进行比对。
结果显示,不同亚型类器官对化疗药物的反应差异显著:多数高级别浆液型(HGSOC)和子宫内膜样(ENOC)类器官对卡铂/紫杉醇方案敏感,而低级别浆液型(LGSOC)和黏液型(MOC)类器官则表现出明显耐药特征,体现了卵巢癌亚型间固有的生物学差异。
在12例具有可评估疗效的病例中,类器官药敏结果与患者化疗反应高度一致。
例如,hgsEOC-10类器官对卡铂敏感,患者经新辅助化疗后CA125显著下降、肿瘤明显缩小,并在手术后长期维持完全缓解;而hgsEOC-22类器官在药敏实验中显示高耐药性(IC50显著升高),对应患者在术后化疗中出现铂耐药,病灶缩小不明显。
与文献报道一致,低级别浆液型卵巢癌普遍对化疗不敏感,本研究中的lgsEOC-1类器官同样表现出高耐药性,患者术后虽完成6个周期化疗,但短期内即出现复发转移。
统计分析进一步验证了类器官药敏检测的预测准确性:总体预测准确率达91.7%,AUC为0.95,κ系数为0.75,灵敏度和特异度分别为100%和66.7%。

△ hgsEOC-22类器官卡铂药物反应及患者PET-CT图像
5、类器官功能检测精准预测患者对PARP抑制剂反应
研究团队评估了10例卵巢癌患者来源类器官(9例高级别浆液型、1例子宫内膜样)对奥拉帕利和尼拉帕利的药物反应,并结合患者的BRCA突变和HRD状态进行综合分析。
结果显示,4例携带BRCA突变的患者中有3例类器官对PARPi敏感,但1例(hgsEOC-11)在体外显示明显耐药,提示其虽然基因检测为HRD阳性,但功能层面并不敏感。
相反,1例BRCA野生型且HRD阴性的患者(hgsEOC-2)类器官在药敏实验中表现出中等敏感性,提示存在“功能性PARPi获益者”,这一发现弥补了传统基因检测无法识别的临床亚群。
随访结果进一步证实了类器官药敏预测的准确性。
hgsEOC-11患者在接受PARPi维持治疗15个月后即复发,符合OReO/ENGOT-ov38研究中对临床耐药的定义,其短暂缓解主要来自化疗而非PARPi疗效;而hgsEOC-2患者虽无BRCA或HRD异常,但在尼拉帕利维持治疗下持续完全缓解超过32个月,显示出持久获益,与类器官药敏结果一致。
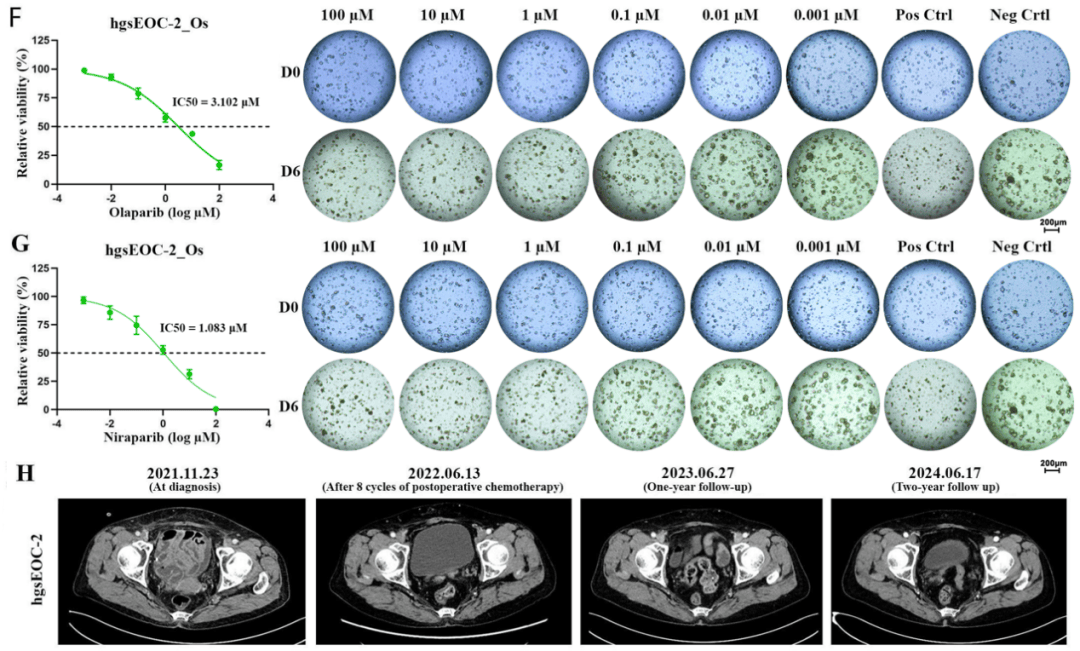
△ hgsEOC-2类器官PARPi药物反应及患者盆腔MRI图像
研究结论
该研究建立了卵巢癌患者来源类器官资源库,并结合基因组与药物反应分析,验证了类器官在反映肿瘤特征和预测疗效方面的可靠性。
结果显示,类器官药敏与患者化疗及PARP抑制剂疗效高度一致,可精准识别敏感与耐药个体,为卵巢癌个体化治疗和类器官指导的精准用药提供了新思路。
