原创 提前十年预防糖尿病的关键:正确对待皮肤信号
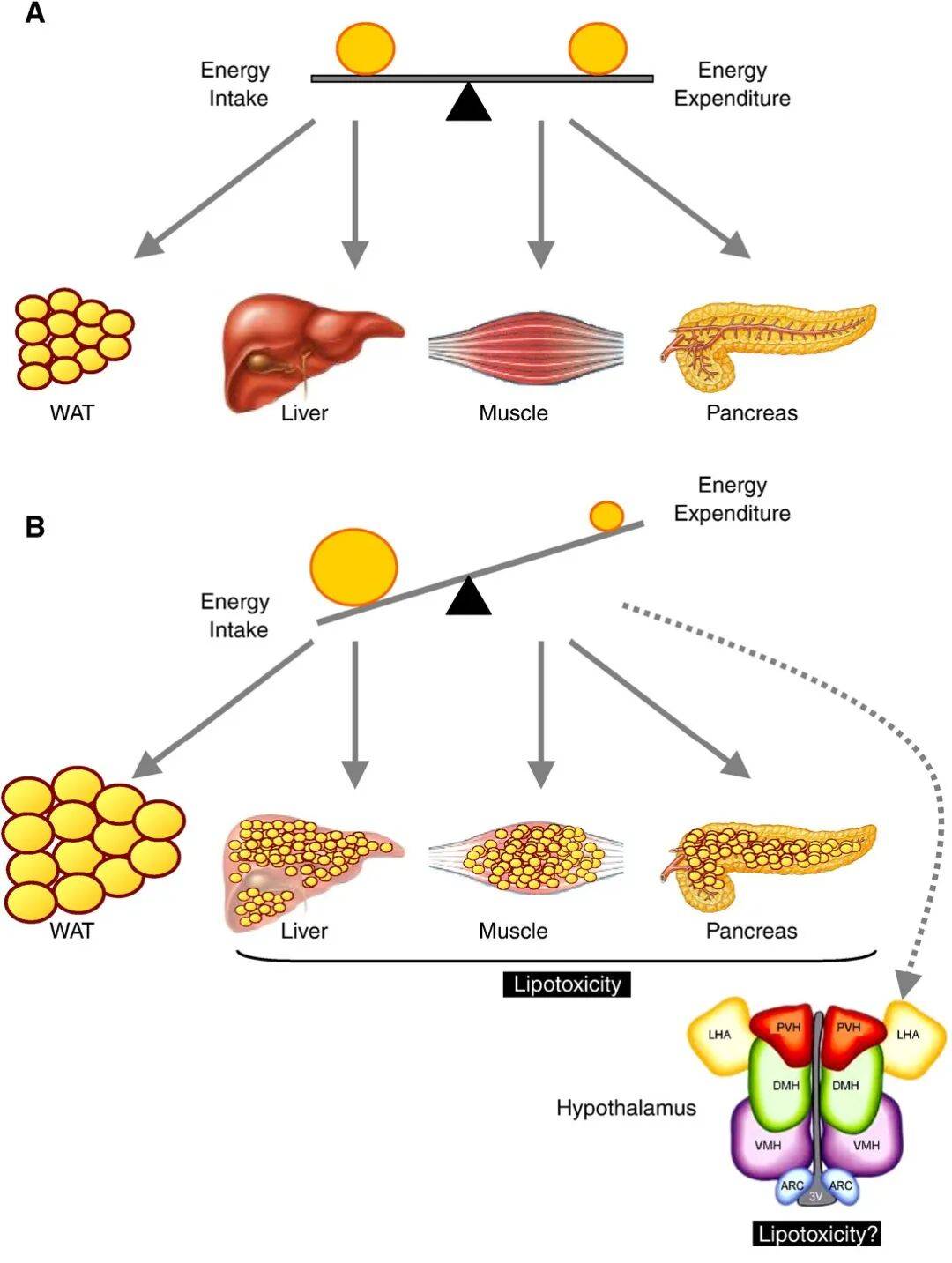
对于将近十分之一的中国人来说,糖尿病可能是最能降低生活质量的疾病之一。当不能享受美食时,生活乐趣好像一下子少了一大半。
虽然糖尿病并不像癌症那样迅速夺命,人们也都知道这是一种可治可控可防的疾病。但实际生活中,怎样预防糖尿病大部分人并不清楚。
很多人觉得按时体检,多关注血糖指标就可以了。实际上大部分人体检时确实非常在意血糖指标,哪怕心有疑惑看到指标正常也会如释重负,觉得万幸没有被糖尿病的阴影笼罩。
实际情况并没有那么乐观,血糖指标确切来说是糖尿病的诊断标准,而不是风险标准。血糖异常已是胰岛素抵抗的晚期阶段的标志,此时胰岛β细胞已大量阵亡(丢失约30%–65%的β细胞功能/质量),目前的医疗水平来说想要逆转疾病并不容易,成功者寥寥无几。
如果能在胰岛素抵抗的更早阶段就采取措施,逆转问题往往非常容易,完全能预防。因为身体早在血糖异常几年甚至十几年前就发出了“警报信号”,而很多人都没看懂,一直没把警报信号当回事。
有人猜测:是不是体检时应该多查点更早期的指标?
当然可以,不过还有更省钱更直观易懂的标志,那就是皮肤信号。
对人体来说,皮肤是代偿能力强、但优先级低的器官。当肝脏、肠道、神经系统、内分泌系统压力上升时,身体会把“多余的炎症信号、解毒压力、代谢压力” 转嫁给皮肤这种“非生命关键器官”,就会出现各种皮肤症状。
皮肤不仅是人体解毒系统的显示屏,也是代谢系统的显示屏。胰岛素抵抗在皮肤有非常明显标志,那就是皮赘和黑棘皮。
本期食与心就带大家了解:皮赘和黑棘皮是怎么回事?胰岛素抵抗是怎样发展的?为什么胰岛素抵抗最早会出现在皮肤?解决皮赘/黑棘皮能预防糖尿病吗?

——皮赘:胰岛素抵抗的早期标志物
大部分人都难以忍受身上长一点有碍瞻观的赘生物,即便不疼不痒,即使别人看不到,自己看着也不舒服。所以看到一个怀疑是皮赘/疣的东西总想把它弄掉。
但问题是:这东西好像能繁殖,会越长越多。虽然皮赘去医院除掉非常方便,弄掉了还能再长新的,让人不胜其烦。
难道是没除根?答案并没有这么简单!
因为多数皮赘是胰岛素抵抗情况下长出来的赘生物,这种情况下不解决皮肤胰岛素抵抗的问题相当于只拆报警器(除皮赘),属于掩盖问题。身体只会继续长皮赘提醒你赶快调整代谢,不幸的是,很多人确实没把两者联系起来,等到真的确诊糖尿病了才后悔莫及。
1. 经常被误认为是疣的皮赘
当皮肤上长出了突起物还越来越多时,更多人、包括医院怀疑是长了疣(verruca),是感染了人乳头瘤病毒(HRV)的后果。
疣是HPV感染人角质形成细胞后,促使表皮细胞持续复制而形成。由于病毒并不进入血液,不会引起免疫系统的猛烈攻击(不引起明显炎症)。疣越长越多的原因不是“感染加重”,而是:局部免疫识别失败 + 自体接种。通过抓、刮、剃、磨就能把病毒带到角质屏障损伤部位(主要是手、足、面部、摩擦区),形成新疣。
但日常生活中,很多“越长越多的赘生物”,并不是疣,而是皮赘(Acrochordons,Skin Tags)。
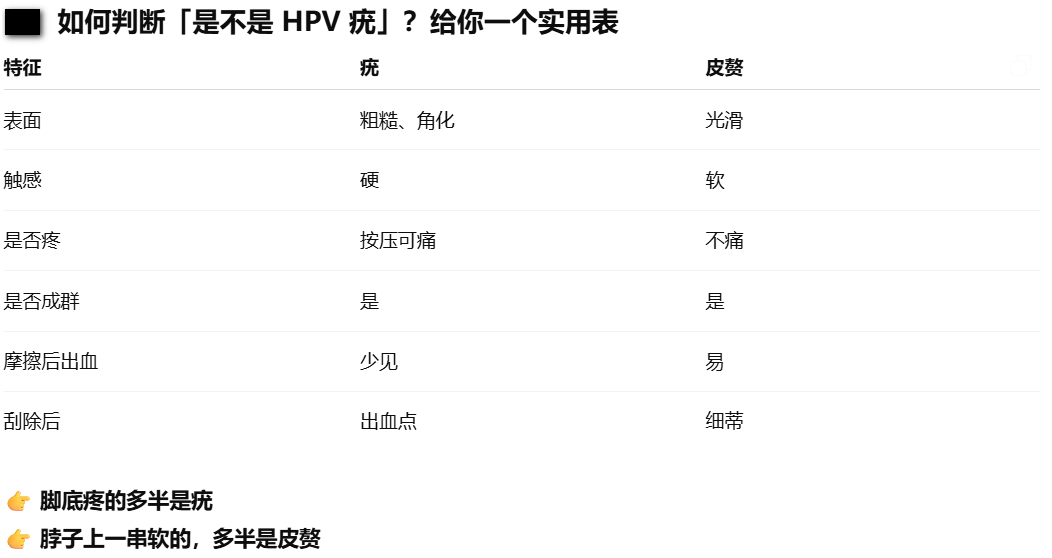
皮赘本质是真皮结缔组织 + 少量表皮的良性增生。颜色接近肤色或略深,软、可晃动,不痛不痒。好发部位:颈部、腋窝、眼睑、胸部、腹股沟、躯干。
皮赘与病毒无关,不会传染,越长越多是代谢/摩擦问题。同一区域持续摩擦+代谢信号长期存在,“条件成熟 → 多点发生”。

根据多项权威医学来源(如NCBI StatPearls、Cleveland Clinic、Medscape等)的流行病学数据,皮赘发生率在一般人群中高达46%–60%。
一般情况下,皮赘在40岁后开始显著增多;到50–70岁时,发生率可达59%–70%以上。男女相似,无明显性别差异。
研究显示,肥胖者皮赘发生率显著高于正常体重者;有多个皮赘的人,代谢综合征风险可增加数倍(有些研究显示高达11倍)。

2. 皮赘与黑棘皮
黑棘皮(Acanthosis Nigricans,AN)是胰岛素抵抗的最经典、最常见的标志性表现。外观:皮肤变黑、增厚、呈天鹅绒样或乳头瘤样粗糙,颜色从浅褐到深黑。好发部位:颈后(最常见,常被误认为“没洗干净”)、腋窝、腹股沟、肘窝、手指关节背侧(三指掌)、唇周、眼睑等褶皱或摩擦区。
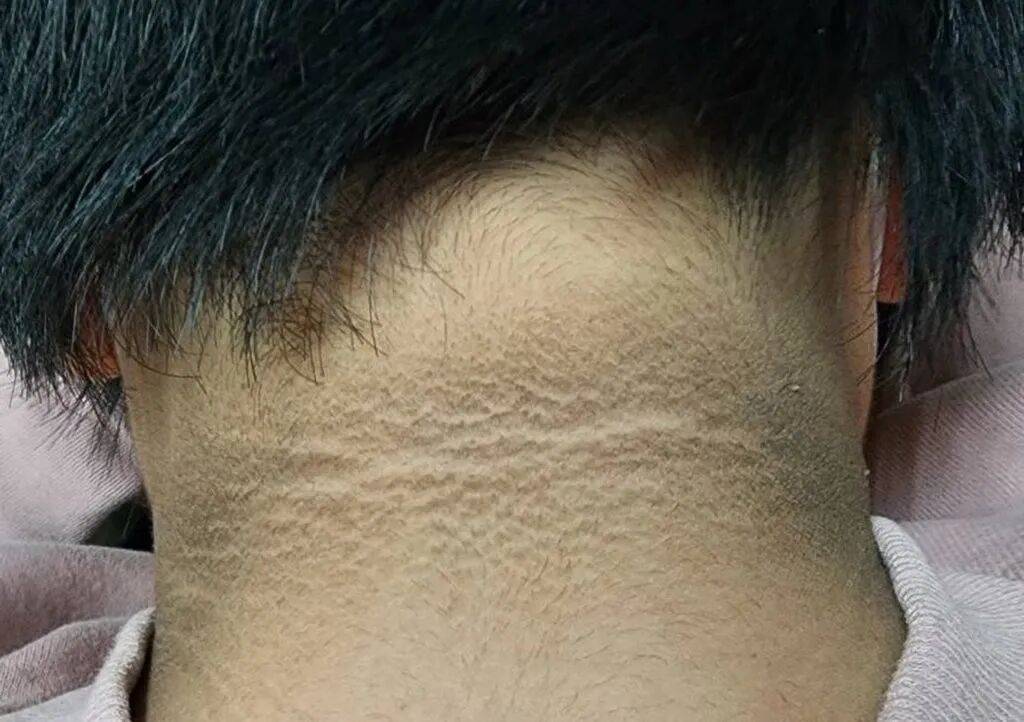
黑棘皮 + 多发皮赘 是胰岛素抵抗最强、最早的“皮肤报警信号”,尤其是年轻人或非典型部位出现时要高度重视。
大量临床研究(包括病例对照研究和流行病学调查)反复证实:皮赘数量多(尤其是>8–10个)、出现在典型部位(如颈部、腋窝、腹股沟)时,提示身体已经出现了胰岛素抵抗问题(至少是局部)。
有黑棘皮的人出现多个皮赘的概率高达19倍以上;反之亦然。不少医生甚至把它们视为胰岛素抵抗的“双生子”(twin signs)。
相较而言,黑棘皮病通常被视为更强的信号(尤其是颈部严重度高时),因为它与HOMA-IR(胰岛素抵抗指数)的相关性更直接、更量化。有些研究甚至认为黑棘皮颈部评分比BMI(身体质量指数)更能预测胰岛素抵抗水平。
——胰岛素抵抗的发展过程
很多人都把体检血糖指标当作自己糖代谢是否健康和糖尿病风险的金标准。实际上,人体胰腺具有强大代偿能力,即便很多组织已经出现胰岛素抵抗,胰腺也会分泌更多胰岛素来“强行”把血糖压下来,维持正常血糖水平。
这个过程可以持续很多年(甚至10年以上),血糖看起来“一切正常”,但背后已经存在高胰岛素 + 组织抵抗。
只有当胰腺代偿到极限、β细胞数量/功能明显降低时,血糖才会开始升高(先是餐后升高 → 空腹升高 → HbA1c升高 → 糖尿病)。
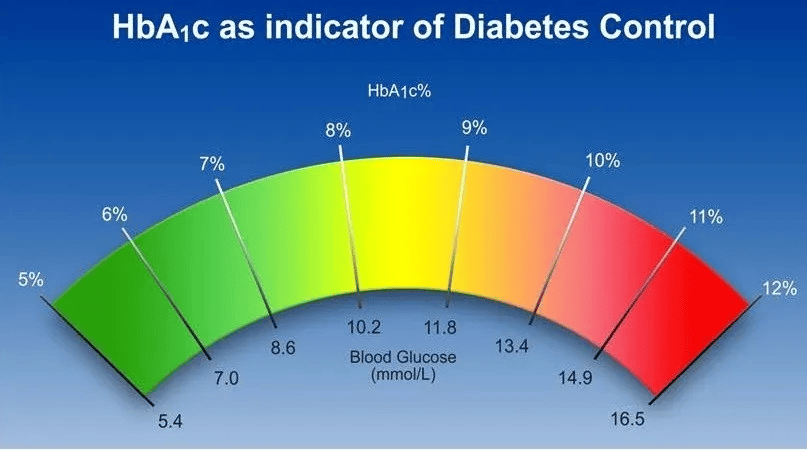
1. 血糖与血胰岛素
所以体检血糖指标正常只意味着没到糖尿病的确诊标准,并不是无糖尿病风险。空腹胰岛素水平和胰岛素抵抗指数是更灵敏的早期标志。

表中HbA1c为糖化血红蛋白,HOMA-IR为胰岛素抵抗指数,OGTT为口服葡萄糖耐量试验。
如果说血糖指标像“火灾报警器响了才知道着火”,而胰岛素/HOMA-IR像“烟雾探测器”,能在火苗刚起时就预警。
2. 胰岛素抵抗发展阶段
胰岛素抵抗(Insulin Resistance)是一种渐进性代谢紊乱,指靶组织(如肝脏、肌肉、脂肪组织)对胰岛素的反应降低,导致血糖调控障碍。它不是突然发生的,而是多因素驱动的慢性过程,通常涉及遗传、环境(如肥胖、高脂饮食、缺乏运动、肠道微生物紊乱)和炎症等因素。
胰岛素抵抗的发展通常遵循“局部到系统性”的模式:先在关键组织(如肝、肌肉、脂肪)出现局部抵抗,然后通过血液异常(如高胰岛素、高血糖、高脂血症)扩展到全身。
由于脂肪、肝脏、肌肉等都是内部组织,且有代偿能力,刚开始出现胰岛素信号异常往往没有可以察觉的症状/异常,而皮肤是屏障和外显组织,绝不掩饰问题。
皮肤不是最早胰岛素抵抗的器官,但是最早把胰岛素抵抗翻译成可见结构变化的器官。早在其他组织出现明显胰岛素抵抗指标之前,皮肤往往已经出现了肉眼可见的胰岛素抵抗警报信号,这就是皮赘和黑棘皮。

——选择性胰岛素抵抗:降糖失效+增生过度
在胰岛素抵抗的早期阶段,抵抗往往是选择性的:
- 降糖通路(抑制肝糖输出、促进肌肉/脂肪摄糖)已经抵抗 → 需要更多胰岛素来维持血糖正常。
- 其他通路(如促进脂质合成、细胞增生、雄激素产生)仍然敏感/甚至过度激活 → 导致高脂血症、脂肪肝、黑棘皮病/皮赘增多、多毛、痤疮、雄激素性脱发等“代谢下游”表现。
这就是选择性胰岛素抵抗(selective insulin resistance)。
2. 胰岛素信号通路:代谢 + 生长
胰岛素由胰岛 β 细胞分泌,受血糖、氨基酸(亮氨酸、精氨酸)、肠促胰素(GLP-1、GIP)等信号调控。
因为游离葡萄糖和脂肪酸对人体的化学毒性,进食后,胰腺会迅速分泌大量胰岛素以降低糖毒性(Glucotoxicty,避免糖化损伤)和脂毒性(Lipotoxicity)。进食后,营养和胰岛素通过肝门静脉到达肝脏,经过肝脏处理后才会进入血液循环。
肝脏是胰岛素的第一靶器官,这里的胰岛素浓度是外周血的2-4倍。肝脏收到胰岛素信号后会灭活其中50-80%,将葡萄糖合成肝糖原,抑制脂肪酸合成。
健康情况下,进食后70-85%的葡萄糖由骨骼肌摄取,10-20%由肝脏合成肝糖原,其他组织(脑、脂肪、心脏、肾脏等)摄取的加起来也不足10%。
餐后脂毒性的解除主要依靠脂肪组织,脂肪组织收到胰岛素信号后会利用葡萄糖合成甘油,然后将游离脂肪酸合成甘油三酯储存起来。
胰岛素结合胰岛素受体(IR) → IR自磷酸化 → 激活IRS(胰岛素受体底物,主要是IRS-1/2)和Shc等适配蛋白 → 分支出两大经典通路。
(1)PI3K–AKT 通路:上述作用主要依赖这条通路,这也是胰岛素最核心最重要的通路,是胰岛素的“主干道”。

(2)MAPK/ERK 通路(促生长/有丝分裂通路),这条通路在胰岛素的促生长和细胞存活作用中更突出。

其他通路多为这两条通路的延伸,有时候mTOR 通路也会被单独列出。
(3)mTOR 通路(营养感知与合成代谢)
mTOR 是细胞的“营养总开关”,胰岛素通过 AKT 激活它。主要功能:促进蛋白质合成、抑制自噬、促进细胞生长、促进脂肪生成。
MAPK和mTOR 两条通路都有助于合成和细胞生长。
2. 胰岛素样生长因子:进一步推高生长
胰岛素和胰岛素样生长因子(Insulin‑like Growth Factor,主要是IGF-1和IGF-2)是高度相关的肽激素家族成员,它们在结构、受体和下游信号通路上存在广泛交织。这种交织允许它们在代谢调控、细胞生长、分化和存活等方面产生协同或重叠效应,但也可能导致选择性响应(如胰岛素更偏代谢,IGF更偏生长)。
IGF 系统主要包括:IGF‑1(最重要,70%以上由肝脏合成)、IGF‑2、IGF 结合蛋白(IGFBP 1–6)、IGF 受体(IGF‑1R、IGF‑2R、IR/IGF‑1R 杂合受体)。如果说胰岛素系统负责人体“代谢轴”,IGF 系统负责的就是“生长轴”。

(1)共同通路+交叉结合
胰岛素和IGF信号都从受体下游分支为三大主干:PI3K/AKT通路(代谢主导)、MAPK/ERK通路(生长主导)、mTOR 通路(合成+生长)。虽然通路高度重叠,胰岛素信号更能激活代谢通路,而IGF信号更能激活生长通路。
胰岛素与IGF为同源激素,可交叉结合对方受体,比如胰岛素弱结合IGF-1R,IGF-1弱结合IR,亲和力降低50–100倍,但高浓度时仍激活共享通路,导致“混合”信号。两者还通过负反馈(如AKT抑制ERK,或ERK磷酸化IRS丝氨酸位点抑制PI3K)相互调节。

这种交织常会放大胰岛素抵抗,导致代谢通路钝化,而生长通路保留甚至过度。
(2)杂合受体
人体很多部位还存在杂合受体(IR/IGF-1R),杂合受体是IR和IGF-1R的异二聚体,在表达两种受体的细胞中随机形成(约占总受体的40%–50%)。

胰岛素受体有两种亚型——IR-A和IR-B,其中IR-A更偏生长,而IR-B更偏代谢。杂合受体中,IGF-1R与IR-A杂合更常见。 杂合体对IGF-1/IGF-2亲和力高(高于纯IR),对胰岛素亲和力中等(低于纯IR)。
杂合体激活下游通路与纯受体类似,但偏向IGF信号(更强MAPK激活,导致生长优先)。因此,无论是胰岛素还是IGF激活杂合受体,结果都是:生长>代谢。
胰岛素和IGF的这种交织能确保生理协调(如生长与代谢同步),但在高胰岛素血症或炎症时易失调,导致选择性抵抗和疾病(如肥胖、增生、甚至癌症)。
(3)皮质醇:推动胰岛素抵抗
最常见的压力激素为皮质醇(CORTISOL),属肾上腺皮质激素,是胰岛素(INSULIN)的系统性对抗者,它的核心任务是:升血糖、动员能量、保证生存。

国内外的多项研究都发现:工作环境压力大、脾气不好、邻里关系和单位同事关系不好的人,无论男女,糖尿病风险都会显著增加。
长期慢性压力时,循环皮质醇水平居高不下,会造成:长期高皮质醇 → 高血糖 → 高胰岛素 → 胰岛素抵抗。
3. 选择性胰岛素抵抗:代谢钝化+合成/生长过度
实际情况中,大多数组织经历的都是 选择性胰岛素抵抗,而不是完全失灵。胰岛素信号中被抵抗的往往是代谢通路,而被保留的多是合成/生长通路。
选择性胰岛素抵抗不是严格线性推进的,更像是多点起火、彼此放大。不同组织供能不同,胰岛素受体类型不同,选择性胰岛素抵抗的表现各不相同。
(1)肝脏:选择性抵抗的教科书
选择性胰岛素抵抗的经典表现是——代谢通路抵抗而生长通路保留,最典型组织是肝脏和皮肤。
肝脏对胰岛素高度敏感,这里有大量胰岛素受体。高胰岛素会驱动肝脏脂肪合成,但不能抑制糖异生(糖原→葡萄糖),导致脂肪肝、高甘油三酯和高空腹血糖(空腹血糖高但餐后不一定特别夸张)。
(2)脂肪组织:选择性抵抗的经典矛盾体
高胰岛素时,脂肪组织”一边放油一边长肉”:抑制脂肪分解的作用(代谢通路)失效,而脂肪合成和脂肪细胞分化功能保留(轻微受损),导致游离脂肪酸持续释放,空腹甘油三酯高、顽固腹部脂肪。
(3)肌肉:代谢通路受损大,合成通路受损小
肌肉原本是餐后葡萄糖摄取的主体,高胰岛素时,肌肉“拒绝”接收餐后血液中的葡萄糖(一般由久坐不动导致),代谢通路坏掉。合成通路受损但在高胰岛素时仍可维持,所以运动后恢复慢但并非不能长肌肉。
肌肉明显胰岛素抵抗是餐后血糖高的主要原因。

(4)皮肤/ 皮脂腺 / 毛囊:抵抗显示屏
皮肤并非专门的代谢组织,而是需要不断维修的屏障组织,这里富含杂合受体,IGF信号和胰岛素信号同样强大(可能更强)。
皮肤胰岛素抵抗中,不仅胰岛素的代谢通路下降,生长通路保留;IGF的两大生长通路也保持强烈活跃。导致:皮脂腺、毛囊、角质细胞过度增殖,炎症增强,屏障修复下降,简单来说就是【皮肤变油、变厚、易发炎】 。
——皮赘:皮肤选择性胰岛素抵抗的后果
皮赘的形成不是“皮肤长错了”,而是:局部皮肤细胞收到过多的生长信号(IGF‑1、胰岛素、mTOR),导致细胞增殖过度。
局部胰岛素高(代谢钝化+生长保留)和 IGF‑1 高,以及摩擦,这三大因素共同推动皮肤快速生长。
1. 胰岛素如何促进皮赘
皮肤里有三种胰岛素相关受体:IR‑A(生长型)、IR‑B(代谢型)、IR/IGF‑1R 杂合受体(强生长型)。
皮赘常见的部位(颈部、腋下、腹股沟)恰好:IR‑A 表达高,杂合受体多,对胰岛素的“生长效应”特别敏感。
当这些部位胰岛素偏高时:
- MAPK 通路被激活 → 细胞增殖;
- mTORC1 被激活 → 生长加速
- PI3K–AKT(代谢通路)部分抵抗 → 形成“选择性胰岛素抵抗”
结果就是:胰岛素的“生长信号”保留,而“代谢信号”下降 → 皮肤局部增生。
2. IGF如何促进皮赘
IGF‑1 是皮肤最强的生长因子之一。它会:强烈激活 IGF‑1R,强烈激活 MAPK–ERK(增殖),强烈激活 mTORC1(生长)。
高胰岛素会抑制IGF结合蛋白表达,增加游离IGF含量;胰岛素激活杂合受体会激活IGF生长通路,这些都会进一步放大IGF‑1 生长效果。
组织学研究也显示:IGF‑1 在皮赘部位的生长信号比正常皮肤强得多。
3. 为什么皮赘喜欢长在摩擦部位
摩擦会导致:局部炎症、局部血流增加、局部皮质醇升高、局部 IGF‑1 表达上升、局部 mTORC1 活性增强。这些因素会进一步放大胰岛素/IGF‑1 的生长信号。
所以皮赘常见于:颈部、腋下、腹股沟、胸下、大腿内侧等位置,这些都是“摩擦 + 温暖 + 局部胰岛素敏感性差”的区域。
4. 压力激素在皮肤的生长放大效应
有些偏瘦、血糖血脂都很正常的人,也会长皮赘,原因主要在于:皮赘是“局部代谢病”,不需要全身代谢病作为前提。
压力信号就足以放大皮肤的胰岛素/IGF信号。
一方面,紫外线、摩擦、病原、炎症等刺激就能促使皮肤细胞合成皮质醇;另一方面,压力大/睡眠差的人肾上腺也会合成大量皮质醇。
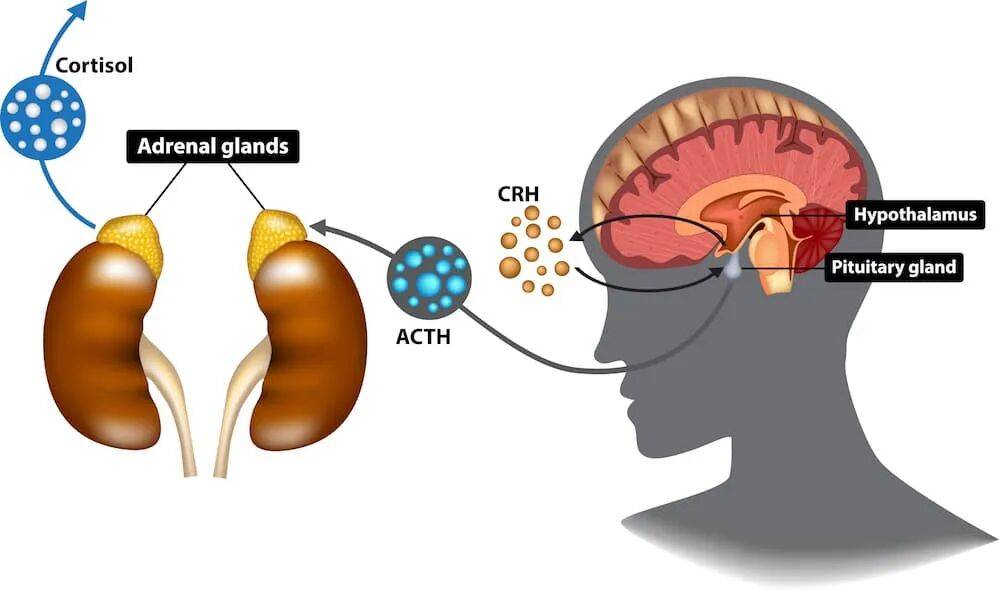
皮质醇在皮肤里会导致:皮肤对胰岛素的代谢通路变弱,皮肤对生长通路更敏感(MAPK、mTOR ),让 IGF‑1R 表达上升, 皮肤更容易增生、角化。此时即便是餐后短时间胰岛素水平略高也能刺激皮肤过度生长。
且皮肤是“局部IGF自治”的大户,不仅会被动接受信号的组织,还能自己合成 IGF;自己调节 IGFBP;自己决定角质细胞更新速度。一旦进入:轻度高胰岛素 + 轻炎症/压力 + 摩擦 状态,皮肤可以在局部“自激活”一个小型 IGF 环路。
后果就是典型的“选择性胰岛素抵抗”:代谢信号下降+生长信号保留甚至增强;结果是:皮肤更容易被 IGF‑1 和胰岛素驱动去“长东西”,比如皮赘、黑棘皮和痤疮。
——黑棘皮:系统性胰岛素抵抗的皮肤窗口
皮赘和黑棘皮的共同根源都是:局部胰岛素/IGF‑1/mTOR 生长信号过度活跃。两者都属于:局部皮肤增生、与胰岛素抵抗相关、与 IGF‑1 信号增强相关、与 mTORC1 过度活跃相关、与摩擦/炎症相关。
皮赘是“点状增生”,黑棘皮是“面状增生”。两者就像是同一路径的不同阶段。

两者的出现取决于信号强度和受体分布。信号包括:胰岛素、IGF、皮质醇、摩擦、炎症等;受体分布则有明显个体差异。
皮赘是“局部生长信号过强”,黑棘皮是“区域生长信号过强”。如果皮赘时,血液胰岛素水平可能在短期升高(比如餐后、甜食后),那在黑棘皮阶段,可能已经出现了长期的高胰岛素血症。
——皮赘时的预防干预
皮赘的本质问题是:局部 IGF-1 / 胰岛素信号过强,它不是炎症型问题,是“生长信号型问题”。
干预核心目标:削弱“餐后胰岛素峰 + IGF 放大”,不需要激进减重,也不需要长期低碳。
饮食干预(优先级从高到低)
1️⃣ 控制“胰岛素峰”,不是总量。避免:空腹高 GI食物、高糖 + 精制淀粉食物。推荐:蛋白 / 脂肪先吃,碳水后吃,注意顺序比比例重要。
2️⃣ 限制 IGF 放大器。避免奶制品(尤其液态,易升胰岛素+升皮肤IGF+激活 mTORC1)、大量精制糖、频繁零食。不是全禁,是减少频率。
3️⃣ 保留代谢灵活性。可:12–14 h 轻断食,或每周 1–2 次低碳日。
生活方式干预:
- 每周 ≥3 次力量训练(增强肌肉摄取餐后葡萄糖的能力);
- 餐后步行 10–20 分钟;
- 睡眠 >7 小时(非常关键);
- 穿宽松衣物减少皮肤摩擦。
需要强调的是:这套干预能让新皮赘减少甚至停止。已经长了的新皮赘很多能停住,甚至变小;而老皮赘多数需要医疗去除。
——黑棘皮时的饮食和生活方式干预
黑棘皮的本质是长期高胰岛素血症,胰岛素 → IGF-1 受体交叉激活,角质形成细胞 + 黑色素细胞同时被推高生长。黑棘皮是系统性胰岛素抵抗的“皮肤警报”。
干预核心目标不是只降峰值,而是要让胰岛素“整体下移”。
饮食干预(比皮赘更严格)
1️⃣ 降低“餐后+空腹胰岛素”。碳水总量:中低(但不极低);明确避免:含糖饮料、夜宵、频繁进食。
2️⃣ 增加胰岛素敏感性信号。高纤维(蔬菜 > 谷物),Ω-3 脂肪酸,镁、钾、锌充足。
3️⃣ 进食窗口管理。14–16 h 断食(如果可耐受),固定进食时间。注意:对于黑棘皮人群,节律比热量还重要。
运动干预(比皮赘更重要)
- 力量训练:必选
- 有氧:辅助(走路 > HIIT)
- 避免过度训练(过度训练易升高皮质醇,反而进一步推动胰岛素抵抗)。
睡眠 & 压力(核心,不是附属)。睡眠不足(会升高皮质醇) = 胰岛素抵抗放大器,长期高皮质醇 → 胰岛素抵抗固化。
干预后,黑棘皮颜色可淡、质地可软,但很慢(数月级), “不再加重”本身就是成功指标。
食与心温馨总结:糖尿病并非一下子发生,从最早出现胰岛素抵抗信号到血糖指标异常往往要经过几年甚至十几年时间。糖尿病也不是在人无知无觉中悄然出现,在糖尿病的发展过程中,身体会不停发送各种胰岛素抵抗的信号,不幸的是,大多数人都无视这些信号,直到体验异常的报告送到手里才想悔不该当初。
体检血液指标检测的是血糖水平是否正常,而更早期的异常是胰岛素信号——胰岛素抵抗。
胰岛素是最主要的降糖激素,但这只是信号。进食后人体摄取糖的主力实际是肌肉(70%以上),其次是肝脏(10-20%),脂肪组织接收到胰岛素信号后会储存脂肪酸,这些能降低血液中游离糖和脂肪酸对身体的毒害。
但如果久坐不动同时摄入过量热量,这些糖和脂肪对于组织来说就成了有害的负担,细胞自然会抗拒,此时就会出现胰岛素抵抗。
肌肉和脂肪会下调胰岛素敏感性(对更高浓度胰岛素才有反应,愿意摄入糖和脂肪酸),肝脏因为大量脂肪酸涌入开始出现脂肪肝,摄取糖减少而释放糖增加。由于血液中游离糖和脂肪酸毒性太大,身体会让胰腺“加班”制造胰岛素,迫使肝脏、肌肉和脂肪脂肪组织继续工作。不过肝脏、胰腺、肌肉、脂肪中的这些变化肉眼并不能看到,也没有特异性的外在指标。
所以在血糖异常之前,血液中的胰岛素水平已经超标很久了。体验血糖超标,意味着胰腺β细胞已经明显损耗,拼命工作也降不下血糖了。此时只能通过药物或者外援胰岛素来帮助身体降低血糖,逆转非常困难。
不过进化给人类留了两个非常显眼的典型胰岛素抵抗指标,这就是皮赘和黑棘皮。
当皮肤中的代谢信号钝化,而生长信号过度(胰岛素/IGF)时,皮肤会过度生长,早期会出现皮赘特别是8-10个以上。即便是经常餐后胰岛素高,或频繁进食胰岛素持续稍微高,就足以在皮质醇和摩擦等信号推动下形成皮赘。
如果血胰岛素水平长期高,则可能出现更显眼的黑棘皮问题。
而皮赘和黑棘皮时期,是糖尿病最理想、最早期也最可逆的干预窗口。就像在森林起火前就扑灭火星,难度远远小于火势蔓延后。
如果在皮赘/黑棘皮阶段就积极调整饮食和生活方式,完全有可能阻断胰岛素抵抗到糖尿病的进程。因此此时胰岛素抵抗尚未固定,β细胞仍然健康,饮食和生活方式干预效果最强。酷爱甜食的人皮肤常常也出很多问题,这也算是另一个证据。
对于皮赘,干预的关键是减少餐后胰岛素峰值和放大生长信号的食物。
对于黑棘皮,则需要同时降低餐后和空腹胰岛素,同时增加促进胰岛素敏感性的食物(比如膳食纤维和ω-3脂肪酸)。
两种情况都需要增强肌肉摄取葡萄糖的能力(特别是力量训练+身体活动),充足睡眠和压力管理(避免皮质醇推动胰岛素抵抗)。
