Nature专题报道:癌症休眠细胞,破解癌症复发之谜与治疗新策略
当丽莎在2017年被宣布乳腺癌痊愈时,她与家人朋友一起庆祝了这个时刻,尽管内心清楚战斗可能尚未结束。果然,2020年,医生在她的骨髓中发现了休眠的癌细胞——这些细胞可能在治疗中幸存下来,隐藏在体内,等待重新激活的时机。丽莎的经历并非孤例,研究表明,高达30%的癌症患者在成功治疗数年后会面临复发风险,而休眠肿瘤细胞被认为是这一现象的关键原因。
什么是癌症休眠细胞?
休眠癌细胞是指早期从原发肿瘤脱离,通过血液或淋巴系统传播到身体其他部位(如骨髓、肺或淋巴结),然后进入一种“睡眠”状态的细胞。
这些细胞具有两个关键特性:生长停滞和治疗抵抗性。它们不分裂或分裂极其缓慢,使得常规化疗(针对快速分裂细胞)对其无效。
休眠状态可能持续数月、数年甚至数十年。在这一期间,患者通常没有任何症状,传统影像学检查也难以检测到这些微量细胞。
有报道称,四位接受过有癌症史捐赠者器官的患者,在移植后16个月至6年内出现了与捐赠者基因匹配的乳腺癌。研究认为,捐赠者的免疫系统可能一直压制着这些休眠细胞,而接受者因服用抗排斥药物导致免疫系统被抑制,使得休眠细胞被激活。
休眠的三种形式与机制
科学家们已经确定了癌细胞休眠的三种主要形式,它们可能同时存在于同一患者体内。
细胞休眠( Cellular Dormancy ) 是最基本的形式,指单个细胞进入细胞周期停滞状态,类似于冬眠。这种状态下,癌细胞下调增殖相关基因,同时上调生存基因,使其能够在不分裂的情况下长期存活。
肿瘤团块休眠( Tumor Mass Dormancy ) 指的是微小肿瘤团块通过平衡细胞增殖和凋亡而保持尺寸稳定。这种平衡可能由微环境限制(如缺氧)或免疫监视维持。
免疫介导的休眠( Immunologic Dormancy ) 是近年来备受关注的机制。研究发现,某些免疫细胞如肺泡巨噬细胞和自然杀伤(NK)细胞能主动抑制休眠癌细胞的活化。
例如,研究团队发现,肺泡巨噬细胞产生TGF-β2蛋白,与乳腺癌细胞表面受体结合,迫使它们保持休眠状态。当研究人员移除这些巨噬细胞后,癌细胞便会“苏醒”并形成转移灶。
微环境:休眠与唤醒的舞台
癌细胞与其周围微环境之间的相互作用是维持或打破休眠状态的关键。
科学家将这种关系比喻为“探戈舞”:休眠的维持和随后的重新激活是细胞与微环境信号之间的一种舞蹈。
细胞外基质的成分变化可影响休眠。一些研究表明,胶原蛋白密度增加和组织纤维化可能为癌细胞提供“苏醒”信号。
衰老微环境的最新研究发现尤为引人注目。2025年7月,中国科学院上海营养与健康研究所的研究团队开发了一种名为DormTracer的新型谱系追踪系统,首次直接观察到化疗后休眠癌细胞的苏醒过程。
他们发现,化疗会引起成纤维细胞衰老和中性粒细胞胞外诱捕网形成,这些变化共同创造了唤醒休眠细胞的环境。
从休眠到复发:触发因素
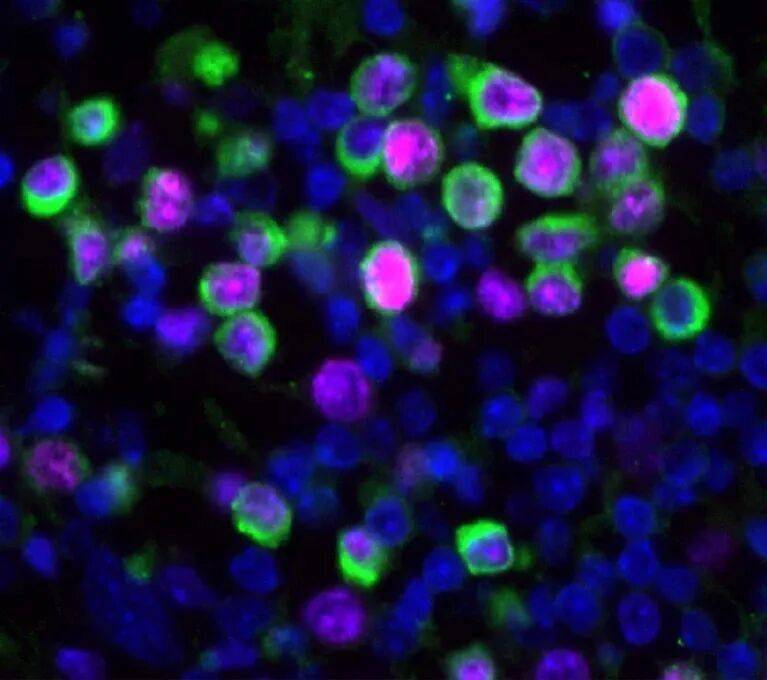
流感感染会迫使休眠的肿瘤细胞开始生长和分裂(绿色)
休眠细胞如何以及为何“苏醒”仍然是癌症研究的关键问题。目前认为多种因素可能触发这一过程。
炎症是主要的触发因素之一。组织损伤、感染或慢性疾病引起的炎症会改变微环境,为休眠细胞提供生长信号。研究发现,流感或COVID-19等感染可能与休眠细胞的激活有关。
免疫系统变化同样重要。年龄增长、压力或免疫抑制药物可能削弱免疫监视,使休眠细胞逃避免疫控制。
表观遗传改变也参与其中。癌细胞可能通过DNA甲基化和组蛋白修饰来重新编程其基因表达模式,从而获得增殖能力
针对休眠细胞的新治疗策略
面对休眠细胞带来的挑战,研究人员正在开发两种主要策略:杀死休眠细胞或永久维持其休眠状态。
靶向休眠相关通路是另一策略。有团队发现了一种实验性药物HC-5404,可靶向休眠细胞在休眠期间存活所需的关键信号通路。在动物实验中,该药成功阻止了休眠癌细胞形成转移灶,已获得FDA快速通道资格。
自噬抑制也已进入临床试验阶段。一种名为CLEVER的II期试验测试了羟基氯喹(自噬抑制剂)单独或联合mTOR通路抑制剂依维莫司的效果。结果显示,联合治疗在87%的参与者中清除了休眠肿瘤细胞。
中国科学家则提出了联合化疗和senolytic鸡尾酒疗法的创新方案。在临床前研究中,达沙替尼和槲皮素(DQ)能够清除化疗诱导的衰老成纤维细胞,从而有效预防肿瘤复发。
科学界对癌症休眠的理解正在深化。随着检测技术的进步和针对性的治疗策略出现,未来十年可能会有更多患者受益于这些研究,告别癌症复发的阴影。
