WHO最新声明: 建议疫苗生产商2026年使用单价LP.8.1作为新冠疫苗抗原组分

2025年12月WHO给出新冠疫苗抗原成分建议,将单价(即针对单一谱系)的LP.8.1毒株作为推荐的新冠疫苗抗原,同时对已获批疫苗持续评估,优先推荐采用LP.8.1作为抗原的更新版疫苗,同时JN.1为抗原成分的疫苗仍然是有效替代选项。经FDA、日本厚生劳动省、疫苗制造商等官网公开报道显示,2025-2026年已审批使用的新冠疫苗信息如下:
以下收集整理了2025-2026年度部分国家已审批使用的新冠疫苗及既往销售情况
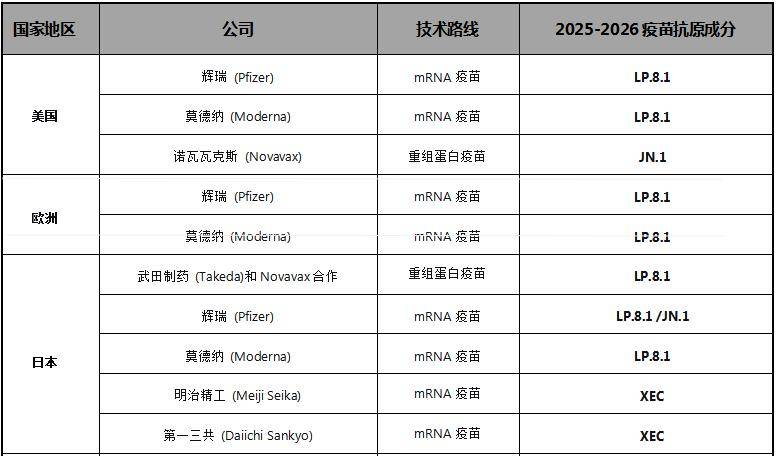
世界卫生组织(WHO)、美国食品药品监督管理局(FDA)及欧盟药品管理局(EMA)等国际部分主流药品监管机构,每年开展两次新冠疫苗抗原成分评估决策会,以动态匹配病毒流行株与疫苗抗原成分,并持续评估已有疫苗的免疫保护效力。这一监管导向既体现了对新冠病毒持续变异风险的科学应对,也为疫苗制造商提供了明确的技术方案。以下整理了国际主流药品监管机构在2025年5月的决策会议给出的建议方案,近期还将继续保持关注,以了解最新的通知:
美国FDA

美国FDA疫苗及相关生物制品咨询委员会(VRBPAC)于2025年5月22日召开会议,讨论并就2025-2026年COVID-19疫苗配方的选择提出建议。
基于整体证据,FDA建议获批新冠疫苗制造商,为了更接近当前流行的SARS-CoV-2病毒,自2025年秋季起在美国使用的COVID-19疫苗应为单价JN.1谱系新冠疫苗(2025-2026配方),优先使用LP.8.1株。
欧洲药品管理局(EMA)

2025年5月,欧洲药品管理局(EMA)建议更新COVID-19疫苗的抗原成分,以用于2025-2026年疫苗接种。EMA紧急工作组(ETF)认为:
优先建议调整疫苗以靶向Omicron亚变种JN.1家族中的LP.8.1变异株,以确保对当前主导株和新出现毒株的交叉反应性。如果有充分理由,也可以考虑靶向其他JN.1后代的疫苗成分。
厚生劳动所


日本厚生劳动省2025年5月28日召集专家委员会,研讨了2025/2026年季节性流感与新冠疫苗的制造株选择。建议2025年/2026年日本使用的新冠疫苗抗原成分可包括:
已确定应与世界卫生组织(WHO)的建议保持一致,即“包含针对单价JN.1、KP.2或LP.8.1的抗原,或包含那些已被证明能对截至2025年5月流行的JN.1谱系变异株产生广泛且有效的中和抗体反应或显示有效性的抗原”。决定将XEC纳入日本使用的新冠疫苗抗原成分之中。
总 结
关于COVID-19疫苗抗原成分的最新声明已发布在世卫组织官网上,敬请查阅:https://www.who.int/news/item/18-12-2025-statement-on-the-antigen-composition-of-covid-19-vaccines.部分发达国家的疫苗生产企业仍然按照WHO和地区监管机构的建议和指导,提供有效抗原成分的疫苗以应对变异株病毒感染引发重症和相关死亡(尤其是对老年人、合并慢性疾病或免疫功能低下的人群的接种指导)。
追溯我国最近一次生产和使用的新冠疫苗的抗原成分是在2023年针对XBB病毒变异株的流行。其中,成都威斯克生物研发的重组蛋白新冠疫苗曾成为全球首个获批紧急使用的含XBB变异株抗原成分的新冠疫苗。包括威斯克生物在内的多家公司该类疫苗在全国范围开展接种。但是随着疫苗有效期、毒株变异、抗原成分需要更新等原因,目前含XBB抗原成分的疫苗已停止使用。
未来我国新型抗原成分的疫苗是否会按照世界卫生组织(WHO)新冠疫苗技术咨询小组建议,继续更新迭代并获得审批应用,随着制造厂商和相关监管部门沟通会逐渐给出结论。
