突破实体瘤治疗瓶颈!北京协和医学院赵海涛团队等研发“三合一”新型免疫疗法破解胆道癌治疗难题
对于全球每年超20万新发的胆道癌(BTC)患者而言,晚期确诊往往意味着有限的治疗选择——化疗联合免疫治疗的传统方案中位总生存期仅约12个月,且副作用显著。近日,一项发表于国际顶级医学期刊《Cell Reports Medicine》的最新研究,或许正为这一领域带来革命性突破:北京协和医学院赵海涛教授等研究团队通过“三合一”策略改造的外周血T细胞疗法(ScTILs),在早期临床试验中使部分晚期胆道癌患者的中位总生存期延长至18.3个月,且安全性远超传统细胞疗法。
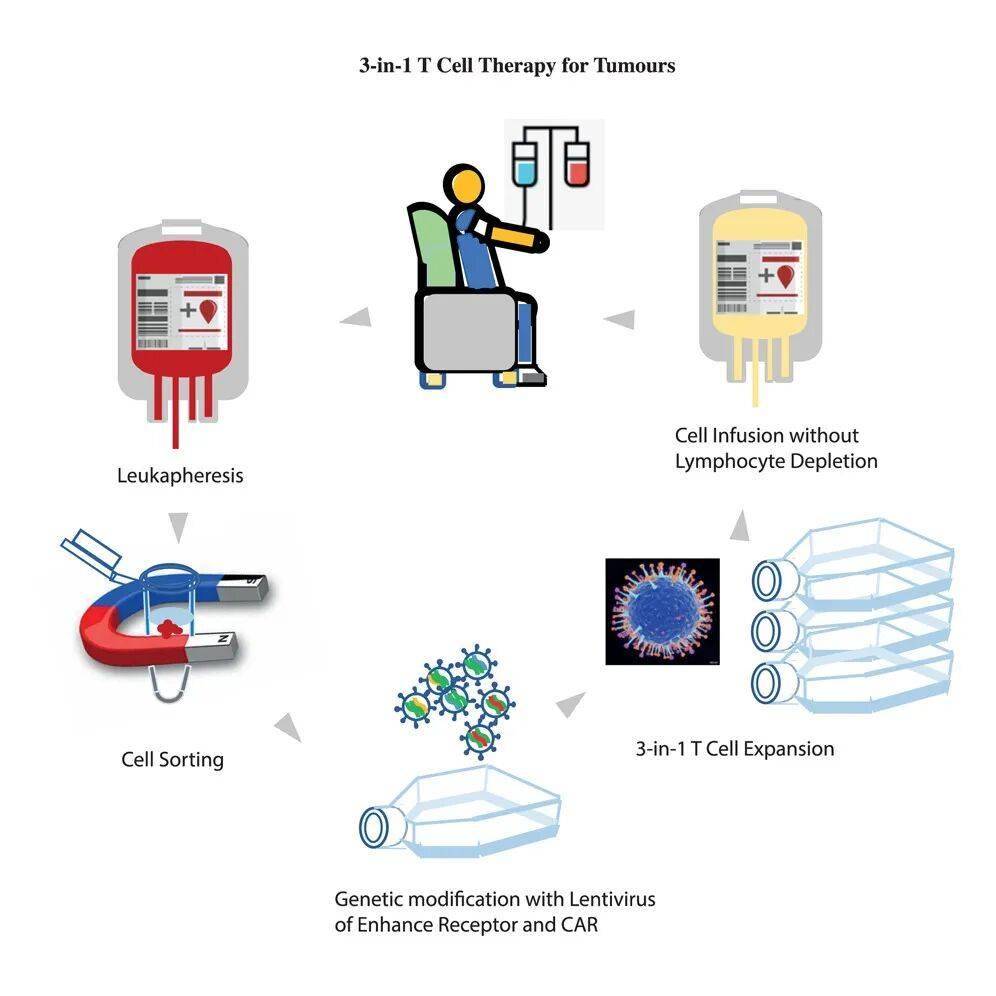
图形摘要
实体瘤治疗三大难关:为何胆道癌成试金石?
胆道癌因肿瘤异质性高、微环境免疫抑制强、T细胞难以有效扩增,长期被视为"最难治的实体瘤"之一。
异质性难题:肿瘤细胞表面抗原千变万化,单一靶点的CAR-T疗法难以覆盖所有癌细胞;
微环境抑制:肿瘤周围分布大量PD-L1等"免疫刹车"分子,导致T细胞失活;
扩增困境:体外培养T细胞易衰老,而依赖手术标本的肿瘤浸润淋巴细胞(TILs)制备复杂、成功率低。
这三大障碍让传统CAR-T在血液瘤的成功经验难以复制到实体瘤。研究团队的目标是为实体瘤治疗找到一把万能钥匙。
“三合一”策略:从外周血中唤醒抗癌大军
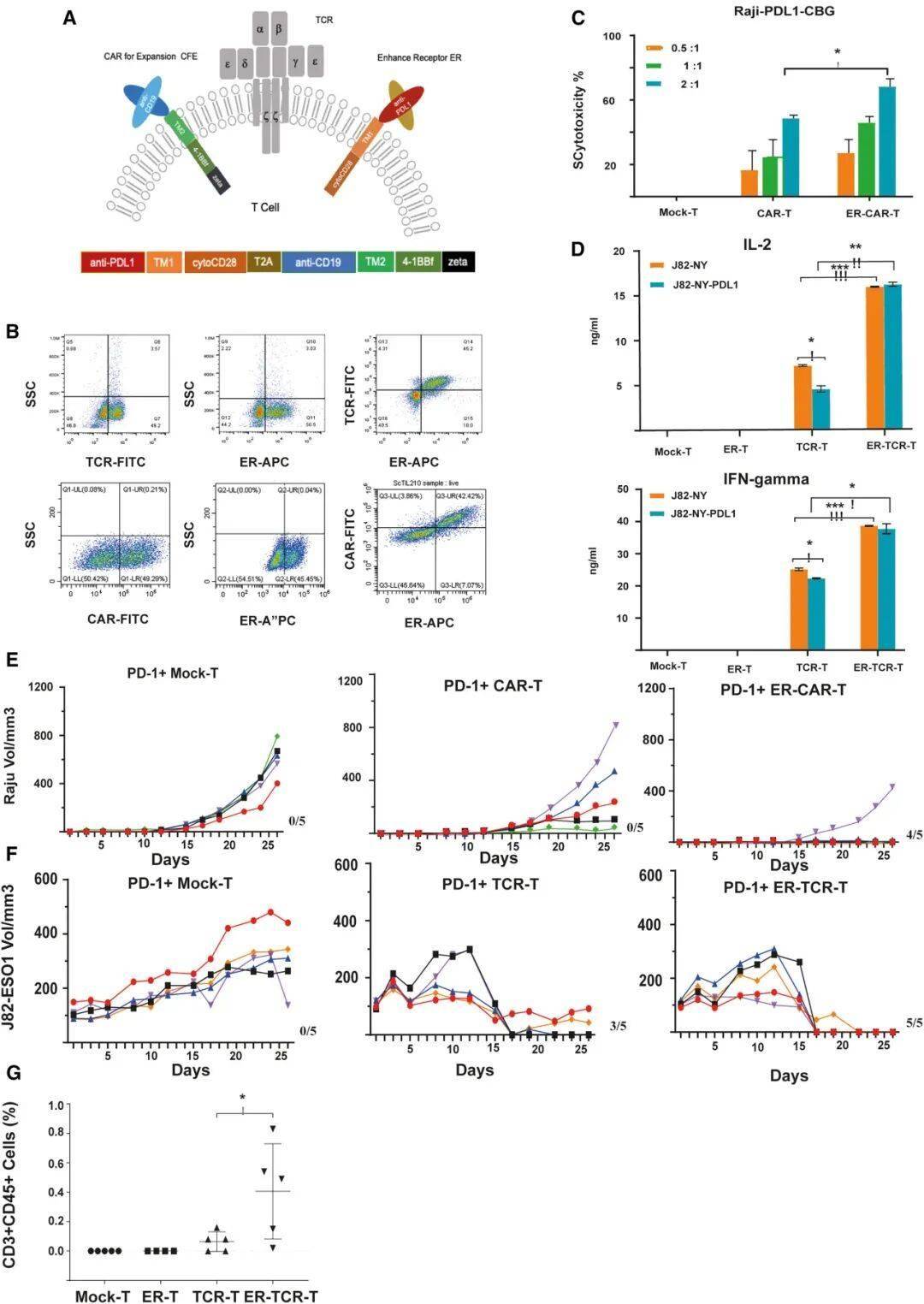
超级循环肿瘤浸润淋巴细胞样细胞(ScTILs)的结构设计:天然T细胞受体(TCR)与增强受体(ER)的整合增强T细胞功能
1、增强受体(ER):融合抗PD-L1抗体片段与CD28共刺激域,如同给T细胞安装信号转换器——当遇到肿瘤释放的PD-L1"刹车"时,ER能将其转化为激活信号,解除T细胞抑制;
2、扩增因子(CFE):搭载靶向CD19的CAR结构,利用患者体内正常B细胞作为扩增引擎,让改造后的T细胞在体内快速增殖,无需体外长期培养;
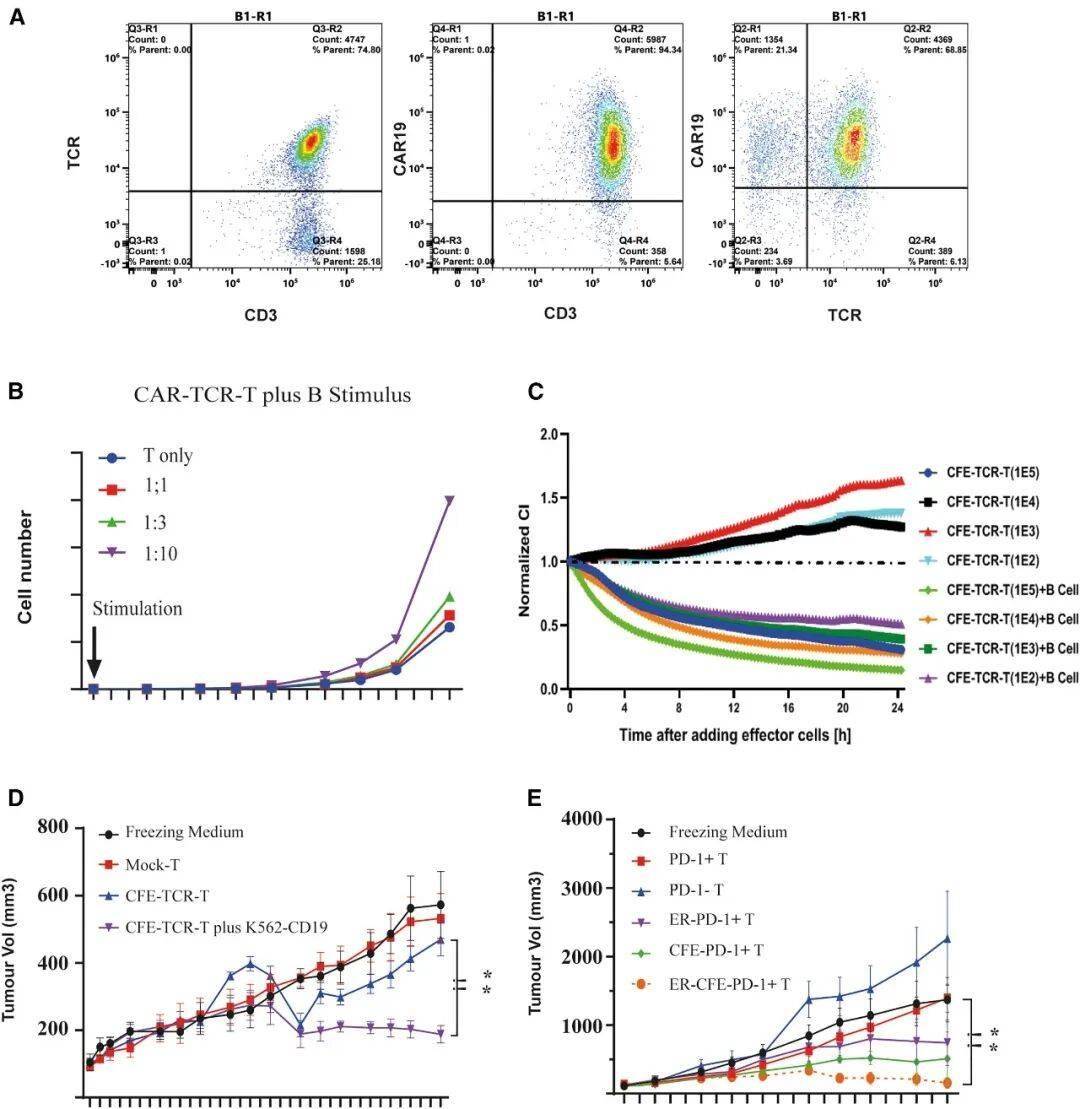
CFE扩增的ScTILs在B细胞存在下体内高效抑制肿瘤生长
从实验室到病床:体外杀瘤、体内控癌双验证
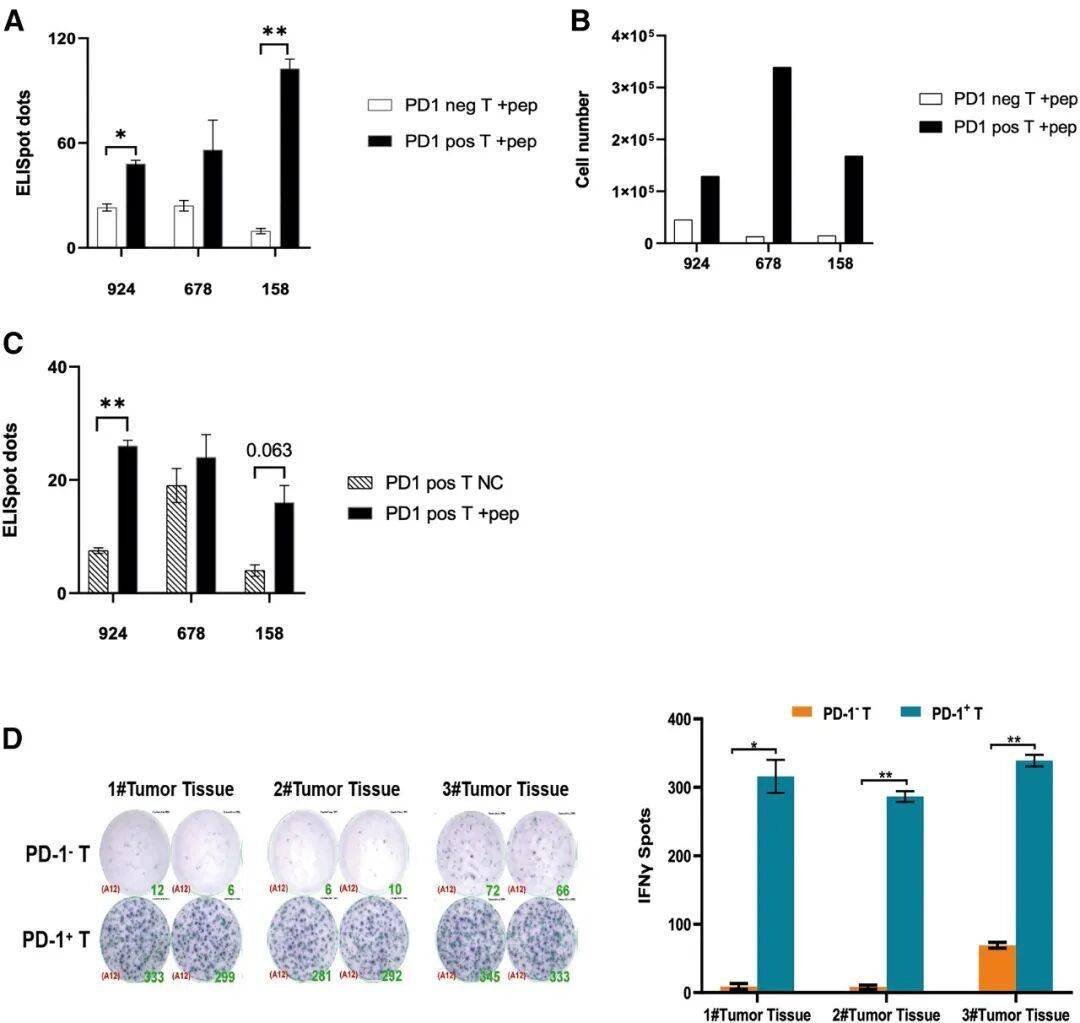
外周血PD-1阳性T细胞中富集新抗原特异性T细胞克隆
为验证ScTILs的有效性,研究团队开展了多维度实验:
体外杀伤实验:改造后的ScTILs对表达PD-L1的肿瘤细胞(如淋巴瘤Raji细胞、膀胱癌J82-ESO1细胞)的杀伤效率较传统CAR-T提升3-5倍;
动物模型试验:在移植了患者来源肿瘤(PDX)的小鼠中,ScTILs治疗组肿瘤体积较对照组缩小80%以上,且随着时间推移持续抑制肿瘤生长;
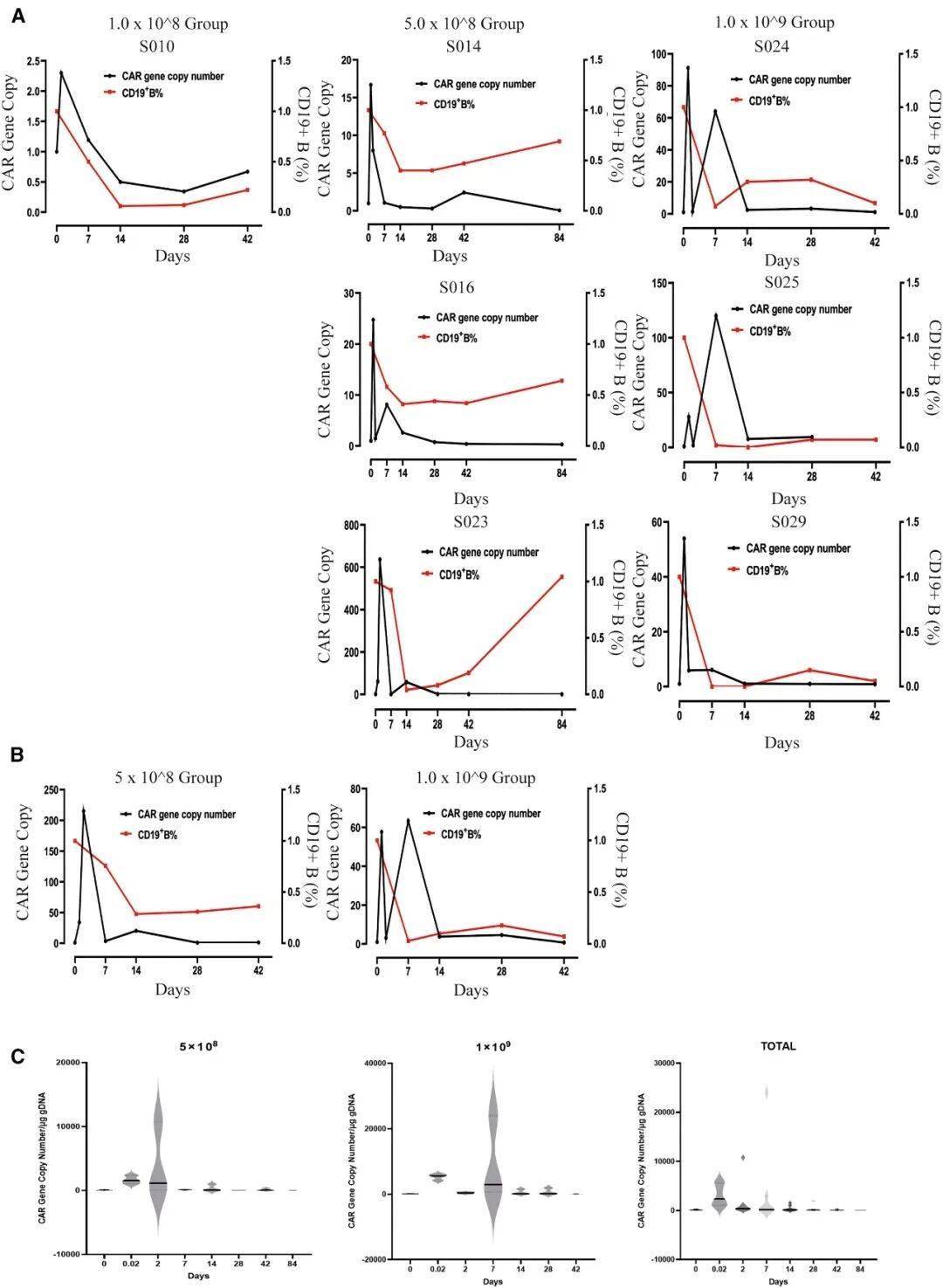
输注后不同时间点CD19 CAR拷贝数及CD19阳性B细胞比例相对于基线的动态变化
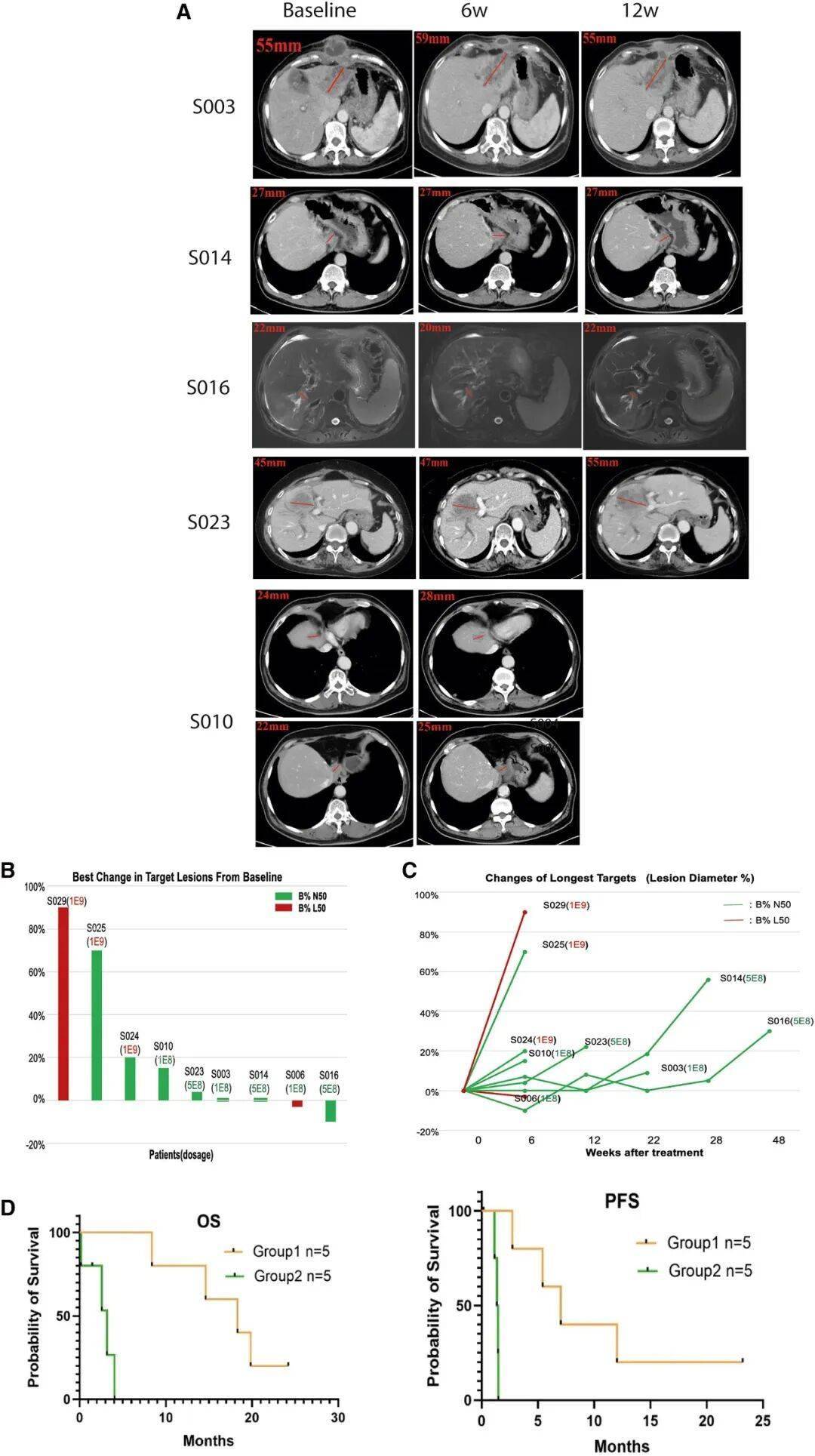
ScTILs治疗的疗效分析
基于前期实验,研究团队开展了小规模临床试验(n=10),纳入经多线治疗失败的晚期胆道癌患者。结果显示:
生存获益显著:在剂量1×10⁸-5×10⁸的"中低剂量组"中,5例基线B细胞水平正常的患者中位总生存期达18.3个月(传统一线治疗仅12个月),疾病控制率(DCR)100%;
安全性突出:未出现3级以上严重副作用,无细胞因子风暴(CRS)或神经毒性(ICANS),仅60%患者出现短暂发热(≤38.5℃),20%出现淋巴细胞减少(与治疗机制相关);
突破传统限制:无需化疗预处理清除淋巴细胞,也无需大剂量IL-2辅助,制备周期缩短至15-21天(传统TILs需3-4周)。
最让人惊喜的是,一位67岁的肝内胆管癌患者(S003),接受ScTILs治疗后肿瘤缩小超过50%,且生存期已超过24个月,这在传统治疗中几乎不可能实现。
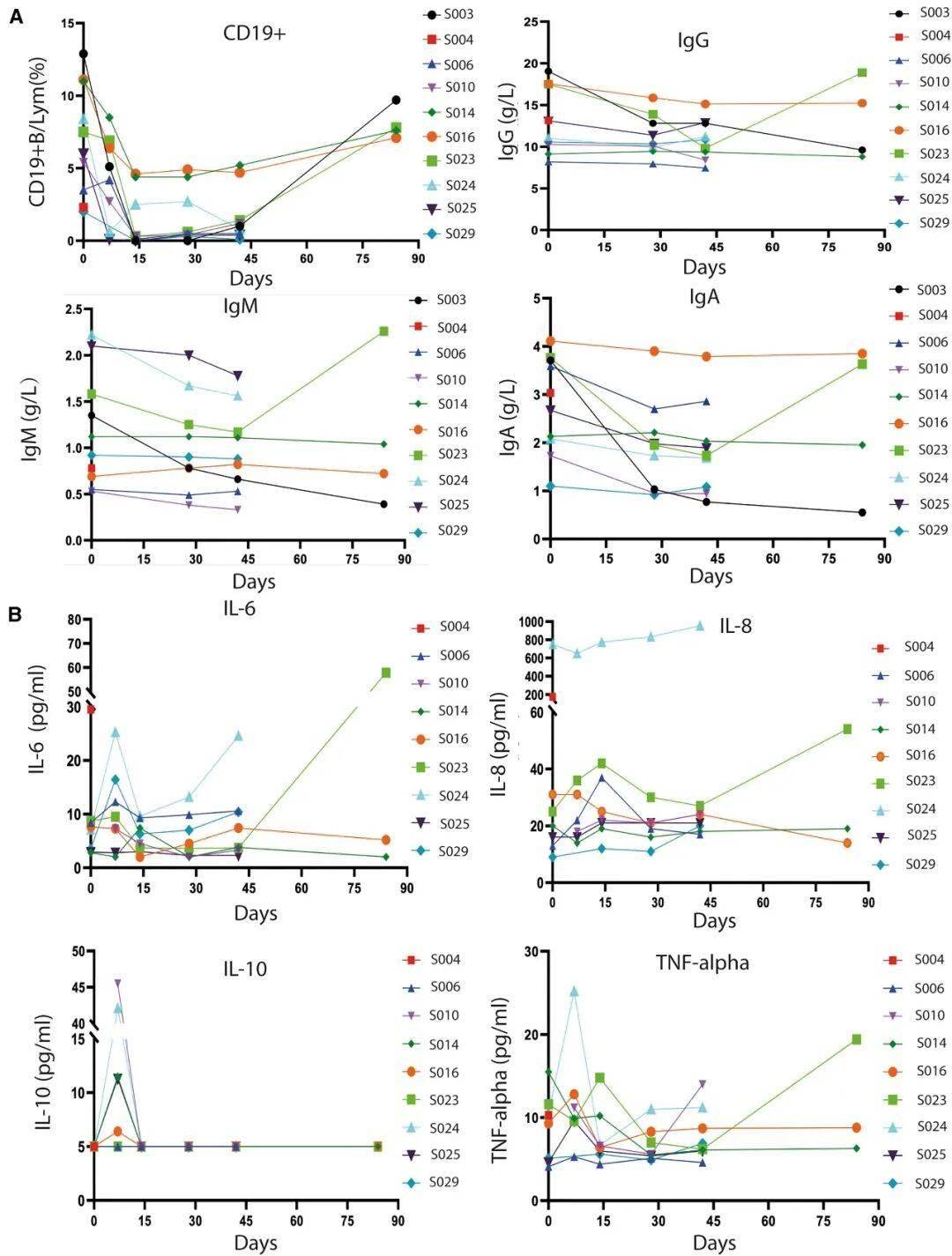
接受ScTILs治疗患者的B细胞药效学指标及免疫球蛋白、细胞因子浓度
总结与未来展望
