皮肤鳞状细胞癌的基因组图谱,27%的患者为TMB-H且预后生存显著更好
尽管了解皮肤鳞状细胞癌(cSCC)患者的基因谱对改善治疗效果至关重要,但目前仍缺乏针对该类患者基因谱的全面研究。自2019年起,日本医疗保险开始覆盖全面基因组分析(CGP),且该国癌症基因组学与先进治疗中心(C-CAT)已将由此产生的数据汇编成综合数据库。在这项回顾性研究中,研究者利用C-CAT数据库中的CGP数据,对日本cSCC患者的基因组特征进行了分析。研究获取了患者的临床和基因组数据,包括化疗方案、肿瘤突变负荷(TMB)和生存状态等信息。研究者对152例患者的病例进行了分析,为确保准确性,仅纳入了经FoundationOne® CDx评估的病例。在这152例患者中,最常见的基因致癌性变异见于TP53(67%)、CDKN2A(54%)、TERT(49%)、CDKN2B(33%)和NOTCH1(18%)。27%(n=41)的患者表现为高TMB(≥10 mut/Mb),该组患者的中位年龄为75岁;73%(n=111)的患者表现为低TMB(<10 mut/Mb),其中位年龄为67岁。
研究背景
皮肤鳞状细胞癌(cSCC)是一种常见的皮肤癌,由角质形成细胞恶性增殖引发,最常发生于日光损伤区域。以顺铂为主要成分的方案常用于cSCC的化疗,但晚期cSCC的治疗仍具挑战性。近年来,免疫检查点抑制剂(ICIs)的应用彻底改变了晚期cSCC的治疗格局。KEYNOTE-629试验证实,人源化抗体帕博利珠单抗在局部晚期(LA)和复发或转移性皮肤鳞状细胞癌(R/M cSCC)患者中具有有效的抗肿瘤活性,且安全性可控。在KEYNOTE-629试验的中期分析中,帕博利珠单抗治疗使LA队列的客观缓解率(ORR)达50.0%,R/M队列达35.2%。抗程序性细胞死亡1(PD-1)单克隆抗体西米普利单抗在晚期cSCC的2期研究中也显示出46.1%的ORR,并已获美国FDA批准。此外,帕博利珠单抗已被批准用于治疗具有高肿瘤突变负荷(TMB)和/或高微卫星不稳定性(MSI)的实体瘤。另外,日本一项研究者发起的试验(NMSC-PD1试验:KCTR-D014)评估了纳武利尤单抗治疗31例上皮性皮肤恶性肿瘤患者的疗效,结果显示缓解率为19.4%(31例患者中6例缓解)。基于这些有前景的结果,纳武利尤单抗于2024年2月在日本获批用于治疗不可切除的晚期或复发性上皮性皮肤恶性肿瘤。
对于标准治疗应答不足的患者,明确cSCC的基因谱对改善治疗结局至关重要。然而,日本缺乏针对该主题的全面研究。全面基因组分析(CGP)在日本已纳入医保,由此产生的数据被汇编成综合数据库,由日本国家癌症中心下属的癌症基因组学与先进治疗中心(C-CAT)管理。C-CAT数据库经申请批准后可供研究人员和企业访问,因此为研究包括cSCC在内的各种癌症的基因基础提供了宝贵资源。
在本研究中,研究者利用C-CAT数据库的CGP数据,分析日本患者cSCC的基因谱,并确定高TMB的发生率。此外,通过阐明这些患者中存在的特定基因突变,研究者希望确定未来可考虑的潜在靶向治疗。由于肺癌研究中已报道TP53和CDKN2A突变患者的TMB显著更高,研究者还研究了cSCC中特定基因突变是否也与TMB状态相关。
研究结果
152例cSCC患者中,111例为男性(73.0%),41例为女性(27.0%),中位年龄为70.0岁(范围21–90岁)。
基因组特征:
图1显示了所有152例cSCC的突变特征。常见的基因致癌性变异如下:TP53(67%)、CDKN2A(54%)、TERT(49%)、CDKN2B(33%)、NOTCH1(18%)、PIK3CA(14%)、HRAS(11%)、KMT2D(11%)、NOTCH2(8%)、FBXW7(8%)、MYC(7%)、KRAS(7%)、EP300(7%)和CASP8(7%)。
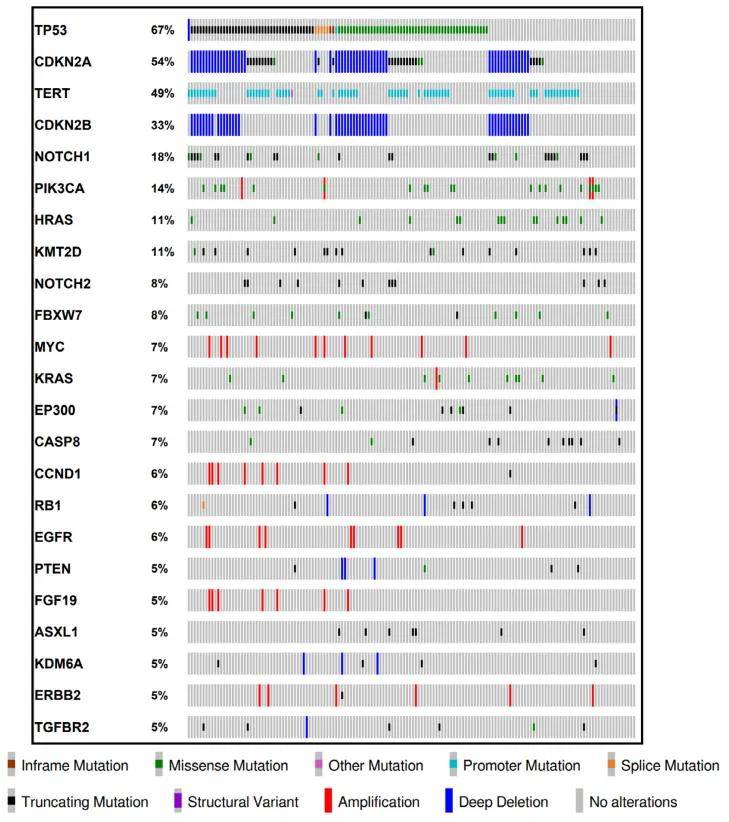

图1
高TMB与低TMB分组分析:
中位TMB为5.0mut/Mb(范围0–85.7)(图2a)。152例患者中,41例(27%)为高TMB(≥10 mut/Mb)(30例男性,11例女性),111例为低TMB(<10 mut/Mb)(81例男性,30例女性)。高TMB患者的中位年龄为75岁(范围45–90岁),显著高于低TMB患者的67岁(范围21–87岁)(P≤0.001,曼-惠特尼U检验)(图2b)。
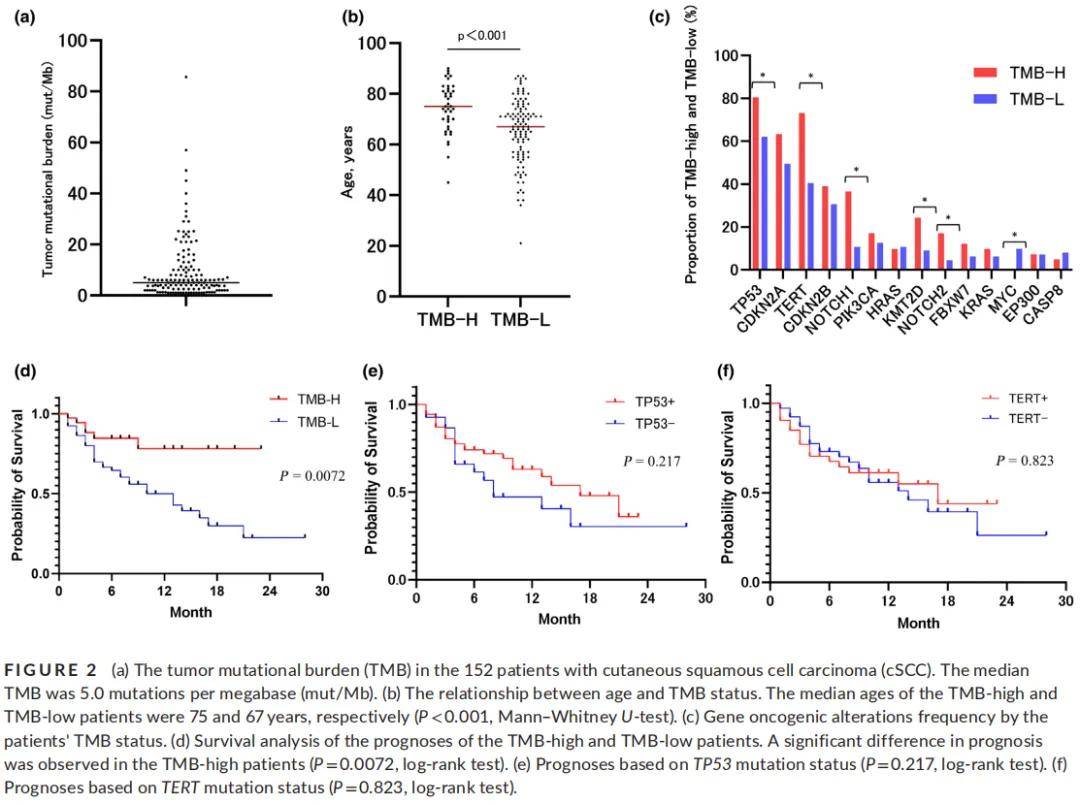
图2
高微卫星不稳定性(MSI-H):
152例SCC患者中,3例(2%)表现为MSI-H,且这3例MSI-H肿瘤患者均属于高TMB组。所有患者的中位TMB为5.0 mut/Mb,而3例MSI-H患者的TMB值异常高,分别为57、33和22 mut/Mb。
CGP检测前的化疗方案:
152例患者中,102例有CGP检测前的化疗方案信息。在这102例中,最常见的方案是氟尿嘧啶+顺铂或卡铂(FP)治疗(36例),其次是顺铂或卡铂+阿霉素(CA)治疗(24例),伊立替康和S-1单药治疗各11例。
102例有既往治疗史患者的TMB为4.0 mut/Mb(范围0–57 mut/Mb)。为探讨既往治疗是否影响TMB,研究者根据CGP检测的组织样本是否在治疗前或治疗后获取进行分析:88例治疗前样本的中位TMB为4.0 mut/Mb,14例治疗后样本的中位TMB为3.0 mut/Mb(P=0.3202,曼-惠特尼U检验)。
高TMB与低TMB肿瘤的基因突变/变异差异:
图2c分别显示了高TMB组(41例)和低TMB组(111例)检测到的基因致癌性变异(突变和拷贝数变异,CNAs)。采用费希尔精确检验分析致癌性变异与TMB的关联:TP53、TERT、NOTCH1、KMT2D和NOTCH2的致癌性变异在高TMB组中显著更常见,各突变的P值如下:TP53(P=0.03)、TERT(P=0.0005)、NOTCH1(P=0.0006)、KMT2D(P=0.0272)和NOTCH2(P=0.0174)。相反,MYC突变在低TMB组中显著更常见(P=0.0365)。CDKN2A、CDKN2B、HRAS、KRAS、EP300或CASP8无显著差异。此外,如图1所示,CDKN2A包含突变和CNAs的混合,因此研究者分别分析突变和CNAs与TMB的相关性,结果显示CDKN2A的突变和CNAs均与TMB无显著关联(P=0.37,P=0.34)。
生存分析:
152例患者中,138例有CGP检测后的生存状态信息。本研究以CGP注册日期为参考点进行生存分析。在138例有预后数据的患者中,99例为低TMB,39例为高TMB。高TMB患者的预后存在显著差异(对数秩检验:P=0.0072)(图2d)。对于突变频率较高的TP53和TERT,研究者分析了突变存在与否与预后的关系,结果显示生存率无显著差异(对数秩检验:P=0.217,P=0.823)(图2e,f)。
讨 论
152例cSCC患者的中位TMB为5.0 mut/Mb,这与既往报道(45.2–61.2 mut/Mb)相比显著更低。本队列中观察到的低中位TMB可能归因于C-CAT数据中缺乏原发肿瘤部位信息,这意味着本队列中源自日光暴露区域(头颈部)的病例可能较少。因此,仅凭这些结果无法得出日本cSCC患者普遍表现为低TMB的结论,需要进一步研究。有报道称,在一系列日本患者中,头颈部cSCC占比45.6%,而白种人中该比例更高,达80%–90%。此外,种族差异也可能影响本研究结果。类似发现在黑色素瘤中已有报道,亚洲患者相比白种人往往具有更低的TMB,这可能与皮肤类型相关。
本研究中高TMB组和低TMB组的中位年龄分别为75岁和67岁,提示年龄与TMB状态可能存在关联。已有研究观察到TMB随年龄增长而增加的趋势,这被认为是由于细胞突变随时间累积所致。尤其在皮肤组织中,紫外线暴露时间也被推测为潜在影响因素。
本分析结果显示,TP53、TERT、NOTCH1、KMT2D和NOTCH2突变在高TMB组中显著更常见,而MYC突变在低TMB组中显著更常见。这些结果表明特定基因突变可能与TMB状态相关。在肺癌研究中,TP53和NOTCH1被报道与高TMB状态相关,且TERT突变与高TMB状态呈正相关。
日本一项纳入29,763例cSCC的流行病学报告显示,性别分布几乎相等,男性14,642例(49.2%),女性15,121例(50.8%),cSCC发病的最常见年龄区间为80–85岁。相比之下,当前C-CAT数据库中注册的152例接受CGP检测的患者中,男性111例,女性41例,性别比为2.71:1,中位年龄70岁,低于一般流行病学统计数据。年龄较轻可能也与化疗纳入标准限制在特定年龄范围有关。
本研究中高TMB患者的总生存期较低于TMB患者更优。关于高TMB状态是否独立于治疗影响预后的证据尚不一致。Devarakonda等人报道,高TMB与非小细胞肺癌患者的总生存期(OS)和无进展生存期改善相关。相反,Shao等人认为,在未接受免疫治疗的10种不同癌症患者中,高TMB可能并非OS的相关因素。因此,TMB与各种癌症生存数据的关系仍存在争议。然而,在研究者当前对cSCC患者的研究中,高TMB状态与患者预后存在关联。
一项主要涉及白种人群的外显子组测序数据荟萃分析显示,以下基因可能在cSCC中发挥致病作用:TP53、NOTCH1、NOTCH2、CDKN2A、HRAS、FAT1、ARID2、CASP8、CREBBP、AJUBA、PTEN、PIK3CA、EZH2、KRAS和CCND1。TERT、KMT2D、FBXW7和MYC也被报道与cSCC相关。在另一项cSCC研究中,FAT1、ARID2和AJUBA突变较为常见,但这些基因未纳入F1CDx检测panel,因此无法分析本队列中这些突变的频率。
2022年基于C-CAT数据库对日本头颈部鳞癌(HNSCC)的研究显示,最常见的突变为TP53(62%)、TERT(56%)、CDKN2A(21%)和PIK3CA(18%),CCND1、FGF3、FGF4和FGF19突变各占18%,EGFR突变占9%。在当前的cSCC研究和上述HNSCC研究中,TP53和TERT均高度常见:本cSCC研究中TP53为67%(HNSCC为62%),TERT为49%(HNSCC为56%)。PIK3CA在两种癌症中均存在,发生率相似(本cSCC研究为14%,HNSCC为18%)。与HNSCC相比,CDKN2A/B、NOTCH1、NOTCH2和KMT2D在cSCC中更为常见;相反,CCND1、FGF3、FGF4和FGF19在HNSCC中较cSCC更为常见。
Kusaba等人最近报道,在单中心143例cSCC研究中,PIK3CA热点突变(E542K、E545K和H1047R)的发生率为4.9%,这些突变的频率分别为1.4%(2/143)、2.8%(4/143)和0.7%(1/143)。在当前C-CAT队列中,频率更高:E542K为4.6%(7/152例),E545K为3.3%(5/152例),H1047R为3.9%(6/152例)。鉴于C-CAT队列包含晚期病例,PIK3CA突变的较高发生率可能与疾病进展相关。本研究中TP53和TERT突变频繁出现,尽管有研究表明TP53和TERT突变与HNSCC和cSCC的预后相关,但本分析未发现这些突变与预后的显著关联。为得出明确结论,需要纳入更多病例并考虑其他临床因素的进一步研究。
在分析患者CGP检测前的既往治疗时,最常见的是FP方案,其次是CA方案、伊立替康治疗和S-1单药治疗。化疗前后采集的组织样本TMB值比较显示,化疗对TMB无显著影响。然而,化疗后采集的样本数量较少(14例),限制了得出明确结论的能力。由于有报道称化疗可影响TMB,未来研究需纳入更多病例,以更好地理解既往治疗对TMB的影响。
本研究的局限性如下:首先,由于数据库的性质,未记录详细的临床数据(包括cSCC原发部位),因此无法进行部位特异性分析;其次,尽管本队列的中位TMB较低(5.0 mut/Mb),提示相当比例的病例可能为非日光暴露的cSCC,但这一点未得到明确证实。为解决这一问题,在注册CGP数据时需确保记录原发部位。
总之,本分析确定了cSCC的基因因素。未来研究应验证这些发现,并探索未经治疗患者的CGP数据。
我司的“实体瘤全外显子组基因检测”和“实体瘤1299基因检测”项目,覆盖了TP53、CDKN2A、CDKN2B、NOTCH1、PIK3CA、HRAS、KMT2D、NOTCH2、FBXW7、MYC、KRAS、EP300和CASP8等基因的CDS区以及TERT热点区域,同时还可检测TMB和MSI,辅助皮肤鳞状细胞癌患者预后评估并指导潜在靶向、免疫治疗。
参考文献:
Kato J, Hida T, Idogawa M, Tokino T, Uhara H. The genomic landscape of cutaneous squamous cell carcinoma in Japan. J Dermatol. 2025;52(3):493-498. doi:10.1111/1346-8138.17592
