视网膜疾病干细胞治疗的最新进展
原创 Samuel Feldman 青白视角 2025年05月28日 20:43 美国
干细胞疗法有望治疗各种视网膜疾病导致的视力丧失,这一前景令人振奋。目前,干细胞疗法正处于 1 期和 2 期临床试验阶段,用于治疗视网膜退行性疾病(RDDs),如年龄相关性黄斑变性(AMD)、遗传性视网膜营养不良和视网膜血管疾病。这些早期临床试验的积极结果为视网膜疾病导致视力丧失的患者带来了希望。
对于一些患者来说,干细胞疗法的前景迫不及待。不受监管的 “细胞治疗中心” 应运而生,它们吹嘘能够使用未经鉴定的付费 “干细胞” 疗法治愈各种视网膜疾病。这些不受监管的治疗已导致部分患者严重视力丧失。尽管这些事件被媒体广泛报道,但许多此类诊所仍在运营。因此,眼科护理人员必须及时了解干细胞疗法的最新文献,以帮助为患者提供咨询。本文旨在概述视网膜疾病干细胞疗法的现状。
01 干细胞
对大多数人来说,“干细胞” 是指多能细胞,即有潜力分化为任何目标细胞的细胞。临床试验中使用的两种多能干细胞是人类胚胎干细胞(hESCs)或诱导多能干细胞(iPSCs)。胚胎干细胞来源于囊胚的内细胞团,囊胚是受精后约 4 至 5 天的植入前胚胎。因此,这些同种异体 hESCs 的使用引发了伦理问题。相比之下,iPSCs 是通过获取成人体细胞并对其进行基因重编程使其表现得像胚胎干细胞而获得的。这种方法避免了伦理和排斥问题。
多能干细胞必须经过分化才能给药,因为它们可能形成畸胎瘤。早期的几项临床试验已探索使用从 hESCs 分化而来的同种异体视网膜色素上皮(RPE)细胞治疗视网膜退行性疾病,如 AMD。这是因为 iPSCs 的发展相对较新且具有挑战性。然而,使用这些同种异体 hESC 衍生细胞需要免疫抑制以尽量减少对移植细胞的排斥。相比之下,自体 iPSCs 可以从患者自身的分化细胞群(如血液和皮肤)中获得,与同种异体 hESC 衍生细胞相比,可能为未来的临床试验提供更强的免疫耐受性。
多能干细胞也在视网膜疾病的临床试验中得到探索。它们包括来自骨髓的自体 CD34 + 干细胞和同种异体胎儿视网膜祖细胞。这些多能细胞已部分分化,分化为各种细胞的潜力更有限。然而,它们可以释放营养因子并增强组织修复。
干细胞治疗的目标是通过旁分泌效应替换受损组织或修复受损组织。组织替换主要使用多能干细胞,如 hESCs 或 iPSCs。通过旁分泌营养效应修复受损组织是多能干细胞治疗的目标。本文讨论的所有临床试验均使用经过充分鉴定并在良好生产规范(GMP)条件下收获的细胞,以确保患者安全(下表 )。美国的临床试验正在 FDA 的研究性新药许可下进行。
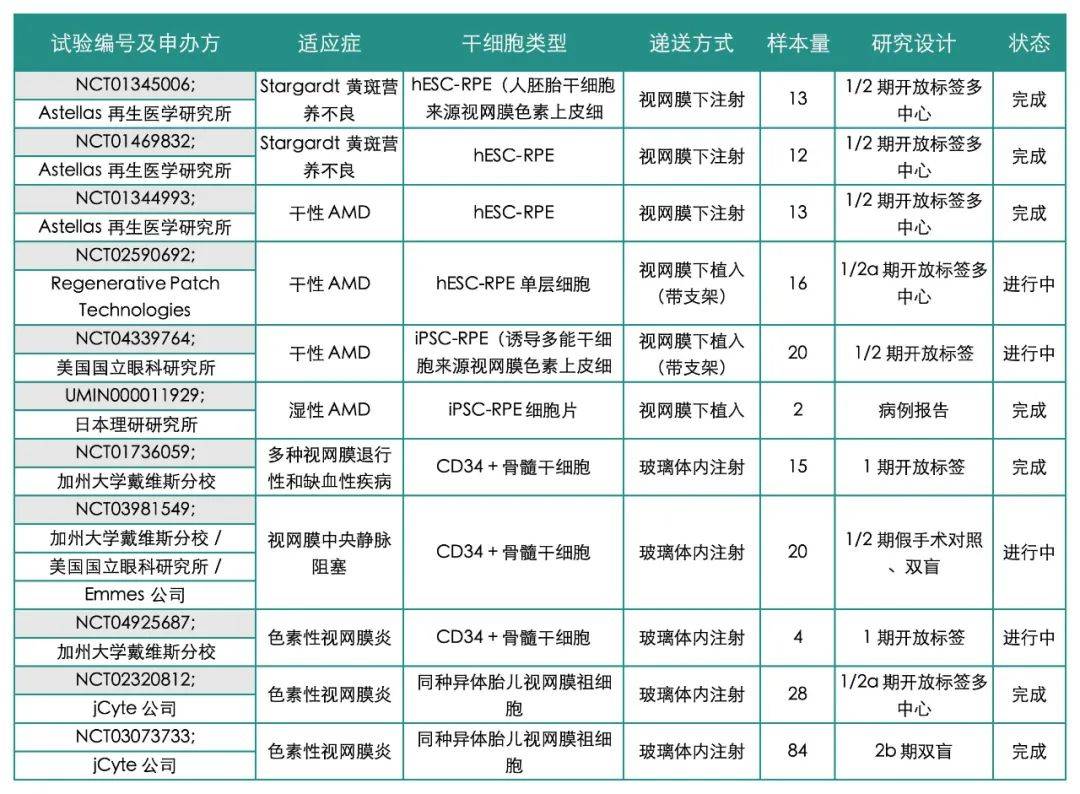
表:视网膜干细胞临床试验总结
组织替代
使用多能干细胞来源的视网膜色素上皮(RPE)细胞的临床试验旨在实现组织替代。对于年龄相关性黄斑变性(AMD)和 Stargardt 黄斑营养不良(SMD)等疾病,RPE 退化是其自然病程。RPE 因其功能不依赖神经突触且呈单层结构,更易于开发,成为研究重点。在这些退行性疾病中,可通过视网膜下注射 RPE 细胞或移植 RPE 单层细胞片来替代受损的 RPE 细胞。为防止同种异体 hESC-RPE 细胞的免疫排斥,许多临床试验采用了口服免疫抑制剂,而自体 iPSC-RPE 细胞的试验则无需免疫抑制。
Astellas Pharma 公司申办的两项 1/2 期开放标签临床试验,通过视网膜下注射 hESC-RPE 细胞悬液治疗 SMD 相关视力丧失。两项研究均表明,该治疗可行且耐受性较好,但少数眼出现视网膜前膜,部分参与者因全身免疫抑制出现副作用。遗憾的是,第一项研究中观察到的视力改善未在第二项研究中重现。
Regenerative Patch Technologies 申办的 1/2a 期开放标签临床试验,正在评估将 hESC-RPE 细胞培养成单层并移植到干性 AMD 继发地图样萎缩眼中的安全性和可行性。RPE 单层细胞生长于支架中,通过手术植入黄斑区地图样萎缩部位下方。1 年后报告显示,除可能与手术操作相关的出血和色素上皮脱离外,植入物耐受性良好,无免疫或炎症反应。此外,1 例患者的死后组织学显示植入物存活并维持功能达 2 年。尽管为开放标签研究,早期视力结果显示约 60% 患者视力稳定或改善,而约 80% 未治疗眼视力恶化,前景令人鼓舞。
日本研究团队成功将 iPSC-RPE 单层细胞移植到渗出性 AMD 患者眼中,1 年耐受性良好,但无视力改善,且因后续生成的 iPSC 存在遗传不稳定性,研究暂停。最近,美国国立眼科研究所启动了一项 1/2 期临床试验,探索支架培养的 iPSC-RPE 单层细胞视网膜下植入的安全性和耐受性,目标人群为 AMD 地图样萎缩所致视力丧失患者。
组织修复
除组织替代外,组织修复是视网膜疾病干细胞治疗的另一重点。多能干细胞释放营养因子,有助于修复各种病理状态下的视网膜。由于多能干细胞无需分化,实验室制备更简便,但给药前需确认细胞产物纯度。玻璃体内注射是一种可行方法,因干细胞无需直接定位于受损视网膜层即可发挥主要再生作用。
可修复受损组织的人类多能干细胞包括 CD34 + 干细胞和间充质干细胞(MSCs),这些细胞是体内天然修复细胞,存在于成人骨髓、脂肪组织等多种器官中。人骨髓同时含有 CD34 + 干细胞和 MSCs,均已在临床试验中得到探索。
骨髓间充质干细胞数量远少于 CD34 + 细胞,但可在组织培养中轻松扩增。自体和同种异体 MSCs 已通过玻璃体内和视网膜下注射用于视网膜退行性疾病治疗,但两种途径均与眼内异常细胞增殖相关,引发安全担忧。
相比之下,CD34 + 干细胞在培养中不易扩增,可能更适合临床应用。这些细胞在组织损伤时被动员至循环系统,定位于受损组织并促进修复。我们团队开展的 1 期研究探索了玻璃体内注射自体骨髓 CD34 + 干细胞治疗视网膜疾病相关视力丧失,发现该方法在视网膜退行性变或缺血眼中可行且耐受性良好。鉴于开放标签 1 期研究中观察到疗效信号,目前正在进行 1/2 期临床试验进一步探索该自体干细胞疗法:第一项是美国国立眼科研究所赞助的 1/2 期双盲、假手术对照、随机研究(TRUST 研究),评估该细胞疗法在视网膜中央静脉阻塞所致视力丧失中的效果;第二项是探索该疗法在色素性视网膜炎中的 1 期开放标签研究。
另一项临床试验正在探索的多能干细胞是同种异体胎儿视网膜祖细胞。jCyte 公司申办的 1/2a 期临床试验评估了玻璃体内注射该细胞治疗色素性视网膜炎的安全性,除轻度眼内炎症外相对安全,视野检查改善提示疗效。目前正在进行 2b 期双盲研究,评估重复玻璃体内注射的有效性和安全性。
02 所谓的干细胞治疗中心
干细胞治疗对多种疾病的潜在疗效引发了公众广泛关注,许多不受监管的付费 “干细胞中心” 在全美涌现。部分中心在 ClinicalTrials.gov 注册以伪装合法性,但其使用的细胞未经鉴定或适当纯化。文献已报道多例严重不可逆视力丧失(有时双眼受累)的病例。在此领域已取得一些进展,FDA 在针对佛罗里达州一家导致 AMD 患者失明的干细胞中心的诉讼中胜诉,该裁决可能赋予 FDA 权力阻止未来未经监管的干细胞治疗诊所运营。尽管有此裁决,这些诊所仍在运营。作为视网膜专科医生,必须警告患者远离这些中心,并基于现有数据进行教育。
03 未来方向
iPSC 技术的发展已可从 iPSC 生成视网膜类器官,这些类器官可模拟视锥光感受器,表现出强烈的光诱发反应,已被用作视网膜研究的体外模型。先前聚焦光感受器替代的研究面临挑战:移植细胞似乎仅向现有光感受器转移细胞质物质,而非完全整合。最近研究显示,视网膜类器官具备形成功能性突触的能力,尽管尚未用于临床试验,但其未来用于组织替代的潜力令人期待。
其他多种细胞治疗新方法仍在视网膜再生的临床前研究中探索,这些新方法可能催生未来的临床试验。
04 总结
尽管干细胞疗法前景广阔,但对视网膜疾病仍属实验性治疗。因此,干细胞治疗应仅作为受监管且密切监测的临床试验的一部分,使用在 GMP 条件下收获和制备的特征明确的细胞。这种视网膜再生新方法的全面安全性和潜在疗效仍未知,需通过临床试验持续研究。
作者:Samuel R. Feldman 医学博士是加州大学戴维斯眼科中心眼科和视觉科学系的玻璃体视网膜研究员。Glenn Yiu 医学博士是加州大学戴维斯眼科中心眼科和视觉科学系眼科教授。Susanna S. Park 医学博士是加州大学戴维斯眼科中心眼科和视觉科学系教授兼视网膜部门主任。Park博士担任TRUST研究首席研究员和研究主席。
