钙化防御 10 大诊疗要点,一张图秒懂
钙化防御(calciphylaxis)是慢性肾脏病,特别是终末期肾病患者的一种的严重并发症,以疼痛性缺血性坏死性皮损为主要表现,其发病机制尚未明确,诊断主要依赖临床怀疑,6 个月死亡率高达 37%,且缺乏获批的标准化治疗方案。
目前临床管理多采用综合策略:包括控制代谢性骨病、以其他抗凝剂替代维生素 K 拮抗剂、停用钙剂和维生素 D 补充剂、优化透析方案以及尝试硫代硫酸钠(STS)治疗等。
近期,一篇发表于 Clinical Kidney Journal 的综述总结了钙化防御的 10 项诊疗要点,以帮助临床医生规避常见误区。本文编译主要内容,供大家参考学习。
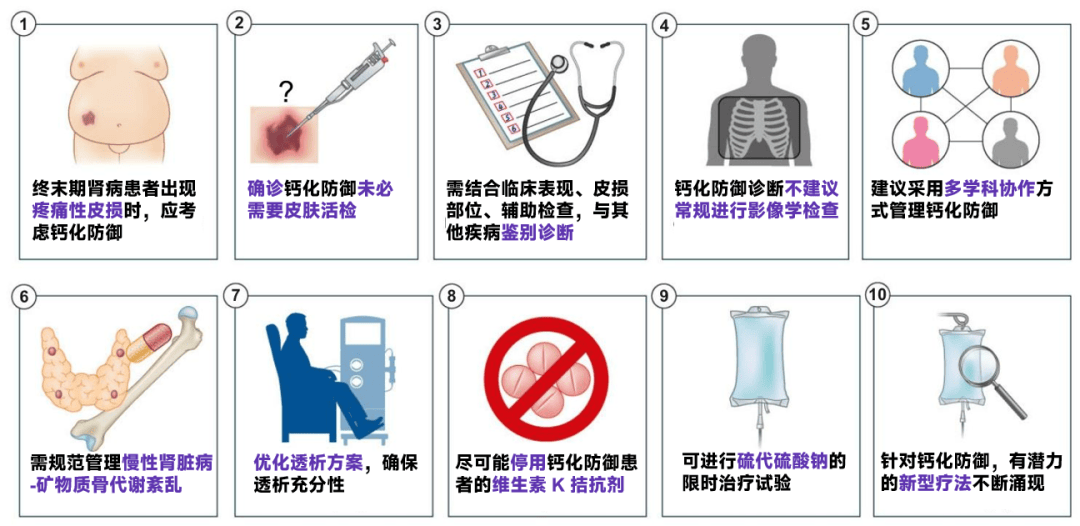
钙化防御管理,10 大要点一图速览
(图源:根据参考文献整理)
01
终末期肾病患者出现疼痛性皮肤病变
需警惕钙化防御
对于晚期慢性肾脏病(CKD)或终末期肾病(ESKD)患者,如出现疼痛性网状紫癜、皮下结节或斑块、难愈性溃疡或皮肤坏死,尤其是腹部、臀部和大腿等高脂肪分布区域,应考虑钙化防御可能。需注意,非 CKD 患者及肾移植受者也可能发生钙化防御。
危险因素包括:女性、肥胖、糖尿病、炎症及自身免疫性疾病、反复皮肤创伤、使用某些药物(如华法林、铁剂、钙剂和维生素 D 类似物)、代谢性骨病指标异常(高钙血症、高磷血症、甲状旁腺功能亢进或甲状旁腺激素过度抑制伴无动力性骨病)以及高凝状态。
02
皮肤活检非诊断必需步骤
钙化防御以剧烈疼痛的缺血性坏死性皮损为临床特征。
早期典型表现包括:青紫色疼痛性皮下结节样斑块、硬结或网状青斑。随着病情进展及血管血栓形成加重,皮损可发展为 缺血性坏死性溃疡伴焦痂(如下图)。相较于肢端(如手指或足趾)皮损,高脂肪分布的部位(如躯干)病变更易呈现典型焦痂样改变。
非典型表现包括:丘疹、类似蜂窝织炎的红斑以及出血性结痂伴糜烂。
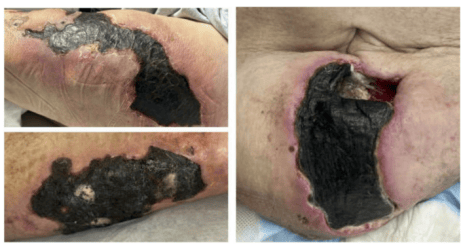
钙化防御患者出现缺血性坏死性溃疡伴焦痂
(图片来源:参考文献)
钙化防御的诊断主要基于患者临床表现和体格检查结果,对于具有典型皮损的终末期肾病患者,皮肤活检可能并非必要。但在诊断不明确时(如非典型皮损或缺乏肾病病史的典型钙化防御表现),建议行皮损周边非坏死区域的皮肤活检以确诊,肢端、阴茎或疑似感染部位禁止活检。
钙化防御的组织学特征为皮下脂肪组织和真皮供血小血管的钙化、纤维内膜增生及微血管血栓形成。
03
需结合临床表现、皮损部位及辅助检查
与其他疾病鉴别诊断
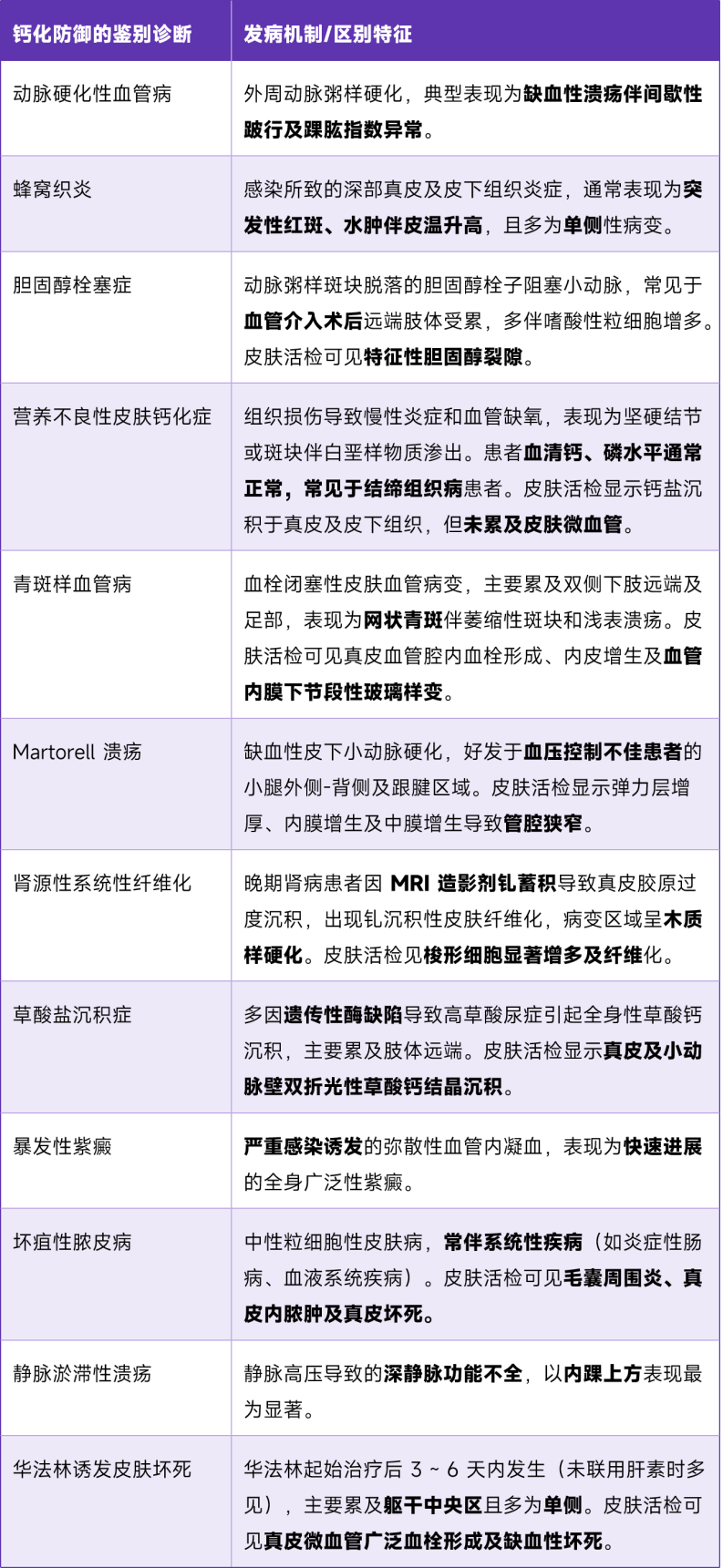
04
诊断不推荐常规影像学检查
影像学检查在钙化防御诊断中的价值尚不明确,因此 仅建议皮肤活检无法确诊或禁忌的情况下进行 X 线或 CT 检查。此外,建议将骨扫描用于检测治疗反应而非辅助诊断。
05
采用多学科协作模式管理
钙化防御的治疗不仅需要肾内科,还需要皮肤科、营养科、疼痛科、整形外科、创面治疗科、康复科和心理科 共同参与。
营养优化是管理钙化防御核心环节,重点改善蛋白质-能量营养不良及促进创面愈合,优化蛋白质摄入 ≥ 1.2 g/kg/天;能耐受者 首选肠内营养,而经口补充仍持续体重下降或严重低白蛋白血症患者可 考虑透析中肠外营养。
多数患者存在的严重低白蛋白血症,可能促进疾病进展,但静脉输注白蛋白的价值尚存争议,故不推荐常规应用。
06
优化慢性肾脏病-矿物质骨代谢紊乱管理
控制血钙、磷及甲状旁腺激素(PTH)水平是钙化防御管理的核心。治疗目标为 维持血磷正常范围并避免高钙血症, 推荐使用司维拉姆或碳酸镧等非含钙磷结合剂,避免使用可能增加血管钙化风险的含钙磷结合剂。同时应停用钙剂及维生素 D 类似物。
建议将 PTH 维持在 150~300 pg/mL。对于 PTH > 300 pg/mL 的患者,应启用西那卡塞等拟钙剂,并根据 PTH 水平调整剂量; PTH 过度抑制( < 100 pg/mL)可能诱发无力型骨病,增加血管钙化及钙化防御风险, 需避免。
另外,目前尚无强证据支持西那卡塞或甲状旁腺切除术对钙化防御的疗效。
07
确保透析充分性、避免钙负荷
建议参照美国肾脏基金会肾脏病预后质量倡议 (NKF-KDOQI)指南优化透析方案。目前尚无证据支持单纯为钙化防御进行强化透析,但对于饮食及药物干预无效的顽固性矿物质代谢异常(如高磷血症、高钙血症、甲旁亢),可考虑延长透析时间或增加频率。
透析方式的选择无特殊限制,推荐使用低钙透析液(含钙 2.5 mEq/L,约 1.25 mmol/L)以避免高钙血症,同时透析液碳酸氢盐浓度不宜超过 35 mEq/L,以防碱中毒加重血管钙沉积。
08
应尽可能停用华法林
华法林是维生素 K 拮抗剂, 可增加钙化防御风险。从机制上讲,维生素 K 对激活循环钙化抑制因子 γ-羧化基质 Gla 蛋白(MGP)和 γ-羧化谷氨酸富集蛋白(GRP)具有关键作用,而华法林使用及维生素 K 缺乏会损害这些蛋白功能,促进钙化防御发生发展。理论上讲,补充维生素 K 可能有益,但其疗效与安全性证据不足,因此不建议常规使用。
对于需要抗凝治疗的患者, 建议尽可能停用华法林。非瓣膜性房颤或深静脉血栓/肺栓塞患者可 优选阿哌沙班等口服抗凝药(尤其适用于估算肾小球滤过率 < 30 mL/min/1.73 m² 或 ESKD),而抗磷脂抗体综合征或机械心脏瓣膜患者 可考虑转换为低分子肝素。
09
硫代硫酸钠治疗建议设定疗程时限
硫代硫酸钠(STS)是一种抗氧化剂和血管扩张剂,此外还能螯合钙盐并减少血管内外钙化,进而减弱脂肪细胞诱导血管平滑肌细胞钙化的能力。
建议尝试 STS 治疗至少 4 周。
静脉 STS 最常用,推荐从 12.5 g 开始,耐受者可逐渐增至 25 g/次、每周 3 次,于血液透析最后 30~60 分钟输注。对于无法静脉给药或缺乏静脉给药通路的腹膜透析患者,可考虑腹腔注射STS 25 g,且维持最长时间;不耐受静脉/腹腔给药者,可行病灶内注射,建议在活动期钙化防御病灶内每周注射 1~3 mL 浓度为 250 mg/mL 的 STS。
STS 治疗的 最佳疗程尚未明确,一般为 3 个月,若治疗 4 周无应答且耐受性差可考虑提前停药。
STS 副作用包括:容量超负荷、阴离子间隙代谢性酸中毒、恶心呕吐、QT 间期延长、低钙血症及腹腔给药相关腹膜炎,需每周监测血钙、碳酸氢根、阴离子间隙及白细胞计数,每 2 周行心电图评估。
10
钙化防御新型疗法
植酸六钠(SNF472):肌醇六磷酸的六钠盐,可强力抑制血管钙化。
高压氧疗:通过提升组织氧合,促进伤口愈合、降低感染风险并缓解疼痛。
双重过滤血浆置换:通过清除 α2-巨球蛋白等大分子蛋白和促炎因子,降低血液黏度、改善组织灌注并减轻全身炎症。
INZ-701:无机焦磷酸盐(PPi)是病理性血管钙化的关键抑制剂,其水平低下与钙化防御及不良预后相关。外核苷酸焦磷酸酶/磷酸二酯酶 1(ENPP1)是 PPi 合成的关键酶,增强其活性可恢复 PPi 水平并改善血管钙化。INZ-701 作为含功能性 ENPP1 的融合蛋白,目前正于血液透析患者中进行安全性、药代/药效动力学评估阶段。
