EASL2025:慢乙肝免疫疗法VTP-300联合PD-1抗体2b期临床初步分析结果公布
VTP-300 是一款由临床阶段生物制药公司 Barinthus Biotherapeutics 开发用于慢性乙型肝炎治疗的治疗性乙肝疫苗,是一种 HBV 特异性免疫疗法,由黑猩猩腺病毒载体 (ChAdOx1-HBV) 剂量和改良安卡拉疫苗 (MVA-HBV) 剂量组成,这两种载体都编码灭活的聚合酶、核心以及共识基因型 C HBV 病毒的整个 S 区。
此前的临床试验显示该药在慢乙肝患者中可诱导对 HBV的持续 CD8+ T 细胞反应以及有意义的 HBsAg降低,包括 HBsAg 阴转。在荷兰阿姆斯特丹举办的2025年欧洲肝病学会年会(EASL2025)上,研究人员报告了 HBV003 研究的初步疗效和安全性数据分析结果。
HBV003 研究是一项正在进行的开放标签、随机、Phase 2b 期研究(NCT05343481),目的是评估VTP-300联合小剂量抗PD-1抗体(nivolumab )(0.3 mg/kg IV)的不同治疗方案对正在接受核苷(酸)类似物(NUC)抑制治疗的非肝硬化慢乙肝患者的安全性、免疫原性和疗效。
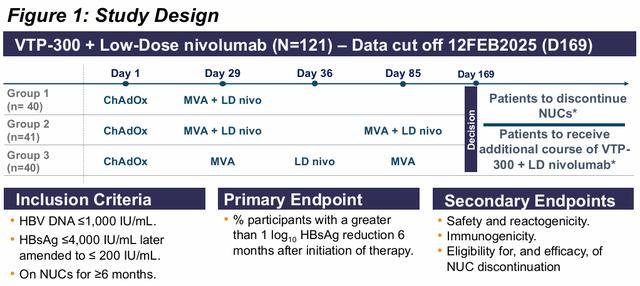
HBV003 共分三组,计划招募 120 名 HBsAg≥10 和 <4000 IU/mL 且HBV-DNA 病毒载量为 ≤ 1000 IU/mL的参与者。随后在筛选时修正为 HBsAg ≤ 200 IU/mL。并排除了被认为有自身免疫性甲状腺炎风险的参与者。
所有治疗组将在第 1 天接受 ChAdOx1-HBV,在第 29 天接受 MVA-HBV,并按治疗组如下进行 MVA 加强和 nivolumab 输注:
第 1 组:第一天ChAdOx1-HBV、第29天 MVA-HBV + 低剂量 nivolumab;
第 2 组:第一天ChAdOx1-HBV、第29天 MVA-HBV + 低剂量 nivolumab、第85天 MVA-HBV 和低剂量 nivolumab;
第 3 组:第一天ChAdOx1-HBV、第29天 MVA-HBV、第36天 低剂量 nivolumab、第85天 MVA-HBV。
如果参与者符合某些标准,在第169天时可停用核苷(酸)类似物(NUC)。NUC停用的患者后续将进行48周的随访,期间只要出现病毒反弹 (HBV DNA>20 000 IU/mL) 或ALT升高 (ALT >2xULN) 和HBV DNA >2000 IU/mL患者均需从新用药。在整个研究过程中收集安全性数据、免疫学数据和 HBV 标志物数据,直至第 336 天。
主要终点的随访已完成,即治疗开始后 6 个月(第 169 天)HBsAg 降低 ≥ 1 log的参与者百分比。安全性和免疫原性的随访一直持续到研究结束。
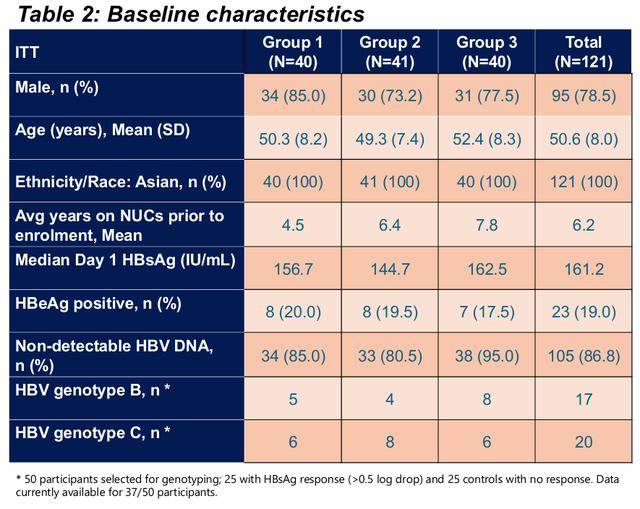
结果,入组 121 名参与者,其中 70 名 (58%) 在筛选时 HBsAg 水平≤ 200 IU/mL。97 名 (80%) 为 HBeAg 阴性,95 名 (79%) 为男性。
受试者基线特征
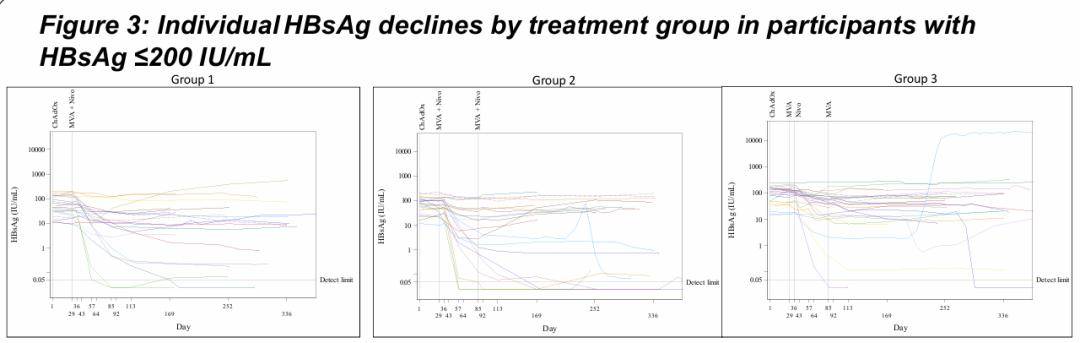
所有三组参与者中有16/121 (13%) 名,其中有 15/69 (22%) 名基线 HBsAg 水平≤ 200 IU/mL 的参与者在第 169 天时 HBsAg 下降≥ 1 log 。最佳治疗组的初步结果显示,对于基线 HBsAg ≤ 200 IU/mL 且同时接受改良安卡拉牛痘 (MVA) 和 低剂量 nivolumab 的参与者,有 8/23 (35%)名的 HBsAg 降低 ≥ 1 log;随后,报告了第 169 天或之后 HBsAg 总阴转率为 6/23 (26%)。

在所有组中,在任何时间点上,有11/70(16%)名基线 HBsAg ≤200 IU/mL 的参与者实现了 HBsAg 阴转。最大比例的这些参与者(n=6)在组2中(如随机分组),接受了一个或两个剂量的MVA/LD nivo。2名参与者实现了功能性治愈:其中一人还经历了HBsAb 血清学转换;另一人在NUC停药后12周内HBsAg变为检测不到。观察到4/70(6%)的参与者实现持续的 HBsAg 阴转(≥6个月),包括两名功能性治愈的参与者。48/68(71%)的参与者符合NUC停药的标准;由于严重不良事件,2名参与者未被评估NUC停药;15名参与者停用NUC,有3名满足协议条件从而需要恢复NUC治疗。
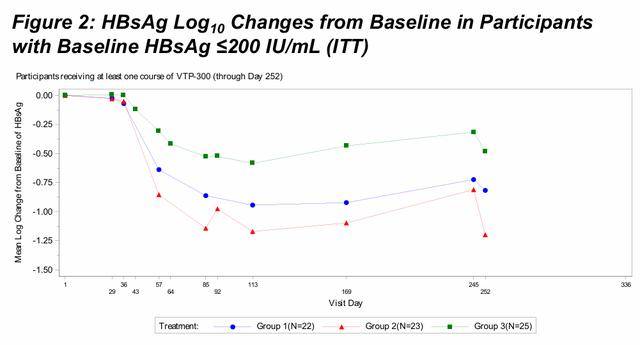
在基线HBsAg ≤200 IU/mL的参与者中,第169天的HBsAg对数均值变化为:组1为-0.92,组2为-1.10,组3为-0.43。在所有组中,HBsAg 在第29天的给药后很快下降,并持续到第169天(数据仍在第169天后累积)。第252天的下降与VTP-300的可选第二疗程相对应,此疗程是通过方案修正引入的(完整数据待定)。
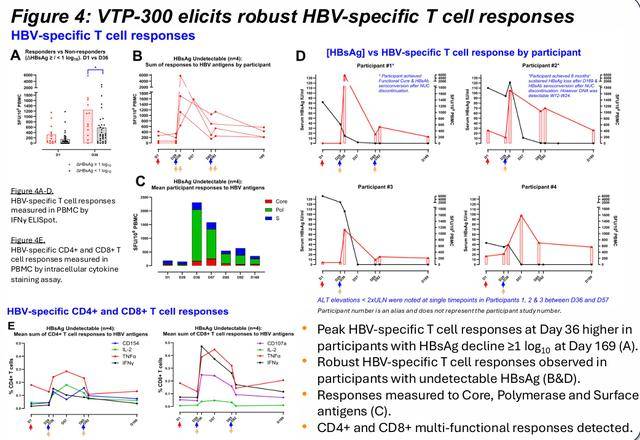
HBsAg在第169天下降≥1 log10的参与者在第36天的HBV特异性T细胞反应峰值更高(A)。在HBsAg不可检测的参与者中观察到强劲的HBV特异性T细胞反应(B&D)。对核心、聚合酶和表面抗原的反应被测量到(C)。检测到CD4和CD8的多功能应答。
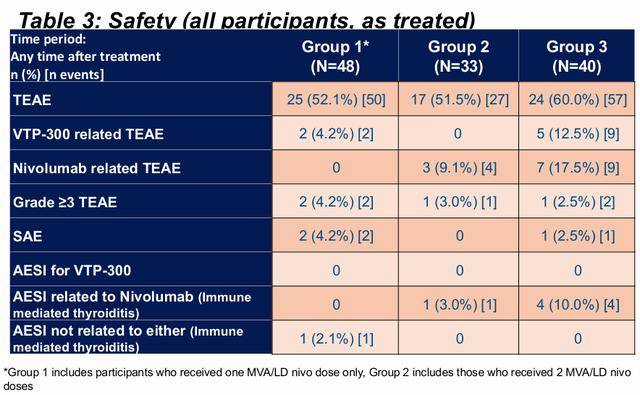
没有报告相关的严重不良事件。一例因无关性心室颤动导致死亡。 两例早期治疗中断(均在组3中):贝尔麻痹;ALT>3倍上限正常值(个别已满足停用规则)。基线后出现3级或4级实验室异常:孤立性中性粒细胞减少症;2名参与者出现ALT升高,同时伴有HBsAg阴转。• 8名参与者的ALT升高超过3倍上限正常值,均发生在首剂MVA/LD nivo后。通常迅速恢复,到D169时均已恢复。报告6例免疫介导的甲状腺炎;其中5例与低剂量 nivolumab 相关。在所有治疗组中观察到14名参与者出现甲状腺功能障碍;为暂时性,12名参与者恢复;两例需要短期治疗。
研究认为,VTP-300 是一种新型抗原特异性研究性免疫疗法,与低剂量 nivolumab 联合给药,在所有 3 个治疗组中,HBsAg 在 D169 的 >1 log 有意义降低;所有 3 种方案均具有良好的耐受性。在 HBsAg ≤ 200 IU/mL 的患者中,VTP-300 和 低剂量 nivolumab 联合的 HBV 定向免疫疗法可以在相当一部分患者中实现 HBsAg 的阴转。有必要进一步研究能降低 HBsAg水平药物和 VTP-300/低剂量 nivolumab 序贯治疗慢乙肝。
关于免疫疗法 VTP-300 这款药Barinthus Biotherapeutics 公司此前已经明确表示在完成正在进行的 HBV003 2b 期临床试验后公司将不再进行投资,寻求潜在合作伙伴进行出售或联合研究。
来源:肝脏时间
