FDA批准Inlexzo膀胱癌新剂型 | 一图读懂:2025年9月上半月全球新药研发进展
创始人
2025-09-17 21:14:01
0次
2025年版第16期《全球药研新动态》
新鲜出炉!
全球新药批准概况
2025年9月上半月,美国食品药品监督管理局(FDA)批准新药申请(NDA)3个。欧洲药品管理局(EMA)和日本医药品医疗器械综合机构(PMDA)均无批准新药。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球药品研发概况
2025年9月上半月,全球进入注册前阶段的新药有4个,其中包括4个新化学实体(NCEs)。
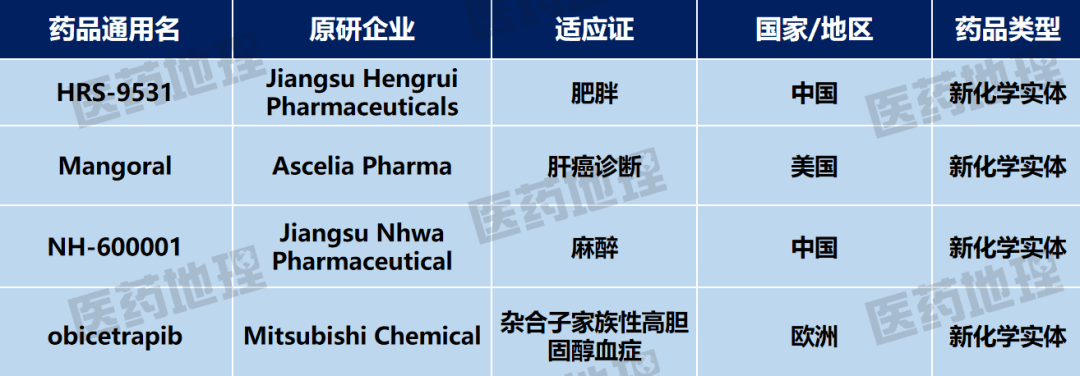
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品注册申报概况
2025年9月上半月,国家药品监督管理局药品审评中心(CDE)共受理新注册申请743件(按受理号计,一次性进口申请除外),具体情况如下图。
统计申报临床的药品数量,CDE新受理临床申请169件(按受理号计),其中国产药128件、进口药41件。
统计申请上市的药品数量,CDE新受理生产/上市注册申请共239件(按受理号计),其中国产药221件、进口药18件。
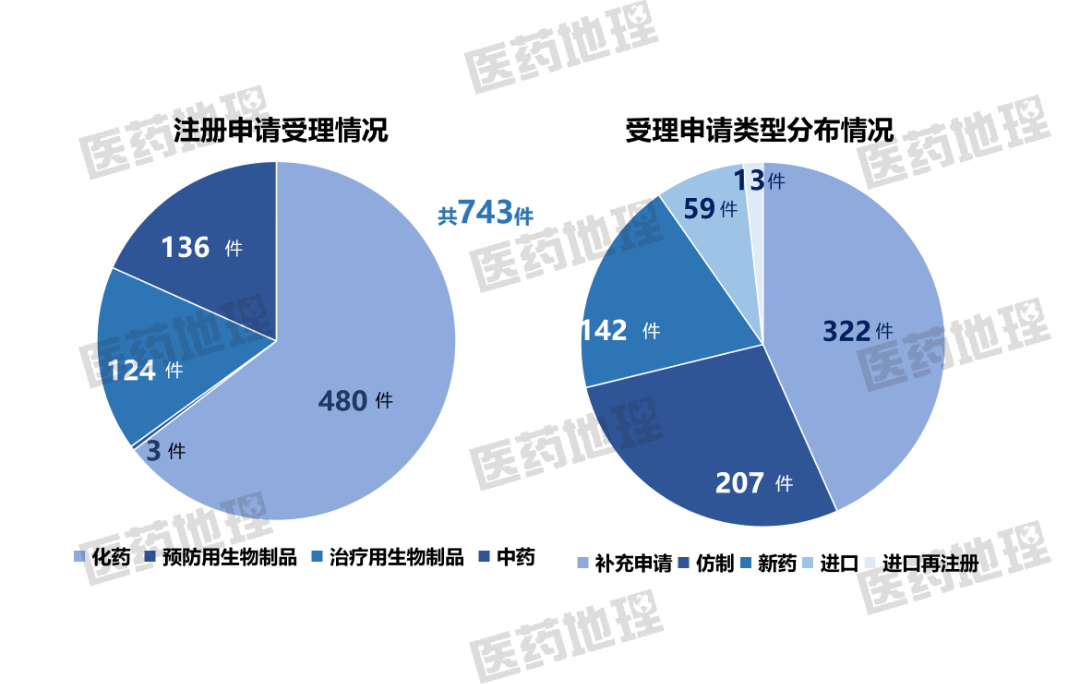
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品批准概况
2025年9月上半月,国家药品监督管理局(NMPA)共批准药品上市申请240件。其中,国产药品232件,进口药品8件。
国产药涉及涉及160个品种,其中包括157个化药,2个生物制品, 1个中药。
进口药品上市申请8件。按产品名称计,涉及6个品种,其中包括5个化药、1个生物制品。
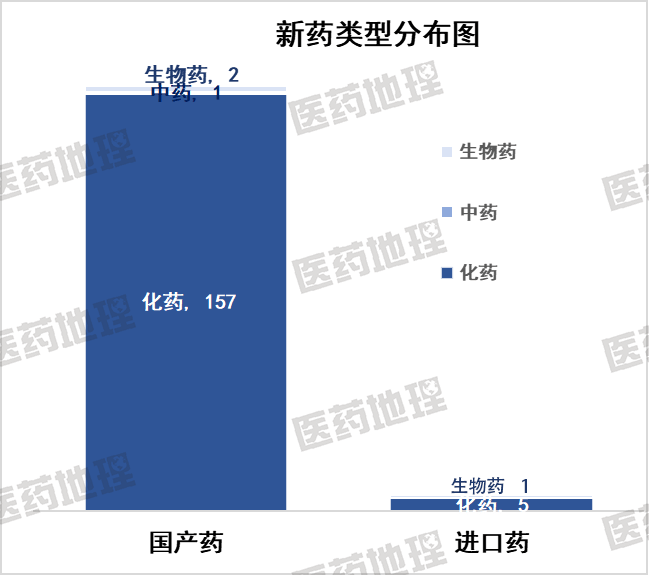
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
相关内容
热门资讯
原创 河...
本赛季中超联赛的竞争格外激烈,无论是争冠还是保级都充满悬念。目前联赛已进行24轮,排名前四的球队都有...
秋吃白,病不来!“白色食谱”带...
口干舌燥、皮肤干涩、咳嗽少痰等不适是不少人秋天的烦恼。中医经典《黄帝内经》早有记载:“秋三月,此谓容...
生孩子后爸爸睡哪里?很多家庭都...
文|菁妈 研究显示,产后第一年是离婚高发期。很多人认为,产后分房睡几乎是导致夫妻关系疏远的最快途径...
有甲状腺结节,饮食有什么讲究?
甲状腺结节患者常陷入饮食焦虑:“能不能吃海带?”“十字花科蔬菜呢?”“加碘盐要不要换?” 其实,结...
这个门诊,能读懂她们情绪的背后...
近日,北京安定医院开设“女性情绪多学科联合门诊”,由精神科、内分泌科、中医科及国内顶尖的妇科内分泌团...
原创 三...
这句口号源自日本,虽然简短,却在那个时代产生了巨大的影响。战后,为了促进儿童的成长,日本政府为小学生...
男性功能障碍调理:3种中成药从...
男性功能障碍(如精力不足、机能减退)多与肝、脾、肾三脏功能失调相关——肾藏精、脾生血、肝疏泄,任一脏...
原创 苏...
曾与美国分庭抗礼的超级大国苏联 最终却走向了分崩离析的结局 在20世纪的历史舞台上,苏联曾是一个...
FDA批准Inlexzo膀胱癌...
2025年版第16期《全球药研新动态》 新鲜出炉! 全球新药批准概况 2025年9月上半月,美国食品...
极目政情|任羽中主动投案,他是...
据中央纪委国家监委网站9月17日消息,北京大学党委常委、副校长任羽中涉嫌严重违纪违法,主动投案,目前...
医萌宝贝-小儿发烧常见的几种处...
现在的社会是高压社会,需要养房子,养车子,同时还要养孩子,而让家长最揪心的就是孩子的养育了,而养育过...
肝强不强壮,喝酒能知道?医生:...
酒桌上,有人一杯接一杯,脸不红、心不跳,第二天照常上班;有人刚碰一口,脸通红,心跳加速,第二天头痛欲...
消化酶如何决定你的情绪与思维
你是否有过这样的体验 午饭吃得很饱,但下午开会时脑子像灌了铅,怎么都提不起精神? 连续几天消化不良后...
全谷物饮食堪称“抗炎卫士” ,...
快节奏的时代,到底怎么做,才是好的养生方式?都市快报推出“养生小招”专栏,邀请优秀中西医养生名医,请...
肠癌术后5年复发率高达60%!...
"晚上2个小时要拉3-4次。体重从120斤掉到了80斤,躺在床上骨头咯得痛。"这是62岁刘先生的心声...
国家财政:1000亿元育儿补贴...
9月12日下午,国务院新闻办公室举行“高质量完成‘十四五’规划”系列主题新闻发布会。 “十四五”时...
学校心理健康筛查:是保护孩子还...
学校心理健康筛查:是保护孩子还是让他们被贴标签? 想象一下,孩子们在操场上嬉戏,阳光洒在他们的脸上,...
秋吃白,病不来!收下这份“白色...
秋季养生的关键在于养护肺脏。有句俗语叫“秋吃白,病不来”,今天就和大家分享秋天如何利用“白色食物”来...
揭开青春期抑郁的神秘面纱:不止...
揭开青春期抑郁的神秘面纱:不止于情绪低落 在大众的普遍认知里,青春期是孩子充满活力、朝气蓬勃的阶段...
蚕豆被关注!研究发现:高血压患...
近年来,随着健康意识的提升,人们对于膳食的关注越来越多,尤其是高血压患者,他们不仅需要控制血压,还要...
