原创 基因 VS 菌群,亨廷顿舞蹈症谁说了算?
有做过基因检测的朋友跟食与心咨询“我携带了好几种易感基因,特别担心,真的会得病吗?”非常焦虑不安。
当一位家庭中有好几位成员都得了同一种慢性病时,人们常常会觉得这是遗传病,基因决定的,没法避免,只能认命。
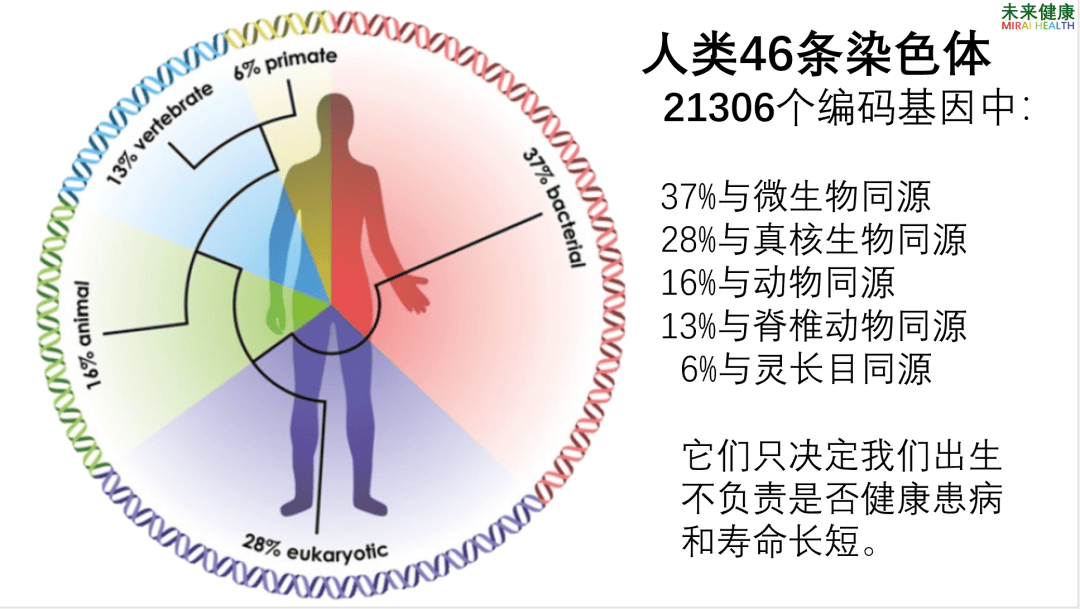
其实事实并非完全如此,并不需要消极认命。近几十年的研究发现,不少慢性疾病,人体自身基因只是影响疾病的可能性,而这种可能性是否出现症状,什么时候出现症状,以及疾病严重程度和发展情况都受另一个重要因素影响,这就是肠道微生物。人类的基因组至少有37%与微生物同源,当人类自身的基因组有缺陷时,作为人类第二基因组的肠道微生物基因组可能有良好的补充作用,除非个体特别缺少共生微生物。
同居的家庭成员往往长时间生活在相同的饮食和空气以及环境微生物密接中,暴露于同样的有害物质(比如甲醛/氡),拥有相似的饮食习惯(比如爱吃煎炸烤的食物,爱吃精米白面,不爱吃豆类全谷物),生活习惯(如抽烟/喝酒/久坐不动)等等,而这些都是导致肠道菌群异常的因素。
再加上家人之间亲密接触(拥抱/亲吻/互用水杯碗碟/互吃剩饭等)时的菌群相互转移,一家人之间往往拥有相似的肠道菌群(差异远远小于陌生人间)。所以家庭中一位成员生病时,其他人也都处于高风险之中,即便没有血缘关系(第一基因组不同,第二基因组相似)。
经常能看到有的家庭一家人都能量满满,健康状态和精神面貌都是满格;而有的家庭就像屋漏偏逢连夜雨,一个人身体坍塌,每个人都似乎受着连带的身心健康扰动。
本期食与心介绍其中一个经典的遗传病——亨廷顿舞蹈症,并讨论这一过去不得不认命的疾病,同时介绍这种疾病现在的研究和治疗进展。
今天的话题非常重要,并不只是写给亨廷顿舞蹈症的人看,而是写给所有面临神经系统发育异常和退行性病变的人看的。对于人类的精神和神经状态的异常,你可以了解各种易感性随时降临每一个人。尽管以亨廷顿舞蹈症为例,其实各种心理疾病和神经系统疾病也包含在内。
——亨廷顿舞蹈症
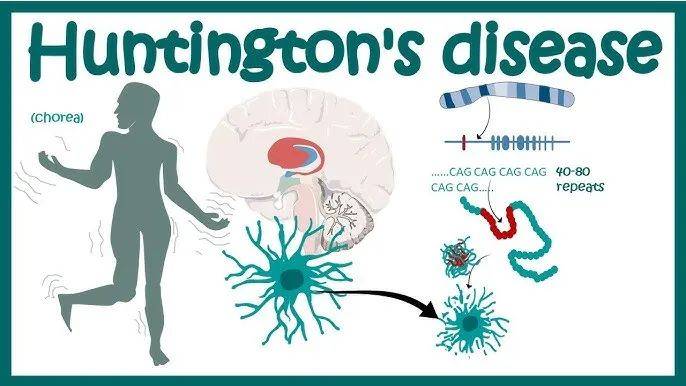
亨廷顿舞蹈症(Huntington's Disease, HD)是一种罕见的常染色体显性遗传病。
1872年,美国医生乔治·亨廷顿(George Huntington)首次对这种疾病进行了详尽描述。他发现一个家族的几代人中都出现了无目的、舞蹈样的运动障碍,详细描述了该病的遗传性、运动障碍和精神症状,并注意到该病“世代相传”,且“迟发”,于是将其命名为“亨廷顿舞蹈症”。常染色体显性遗传意味着只要身上带有这个基因序列就必然患病,而且不分男女。

20世纪的分子遗传学研究最终确认,导致这种疾病的是第4号染色体短臂(4p16.3)基因突变,并将这种基因称为亨廷顿基因/HTT(Huntingtin gene),其编码的蛋白质则为亨廷顿蛋白。
实际上每个人都有HTT基因。正常人HTT基因编码区的CAG三核苷酸重复序列(编码谷氨酰胺)重复数不超过35次,即(CAGCAGCAGCAG.......)<35,而患病者重复数则在36次或以上。而CAG重复数越多,亨廷顿症发病年龄则越早。95%以上亨廷顿突变基因携带者成年后才发病。

HTT基因突变(异常的重复数)会编码出突变亨廷顿蛋白(mHTT)。虽然mHTT的影响尚未完全弄清,但研究确认,mHTT会像导致阿尔茨海默病的β淀粉样蛋白,发生错误折叠并形成聚积体时导致神经细胞死亡。特别是基底神经节和背侧纹状体最先受累,随后累及大脑其他区域。

由于发病后患者的行为、认知和情绪等大脑功能逐渐减退(大脑退行性病变),这种疾病与帕金森症和阿尔兹海默症等疾病都被归类入神经退行性疾病。
——父母都没有亨廷顿症,孩子会得吗
对于这类疾病,很少有人称之为基因病,中文习惯称为遗传疾病,因此人们总觉得一定是父母传给孩子的,这类疾病多数为隐性遗传。但实际上,作为显性遗传,在父母双方都健康的情况下,孩子仍有可能罹患某种遗传病,虽然可能性很低。具体到亨廷顿症,情况可能有两种。


——携带HTT基因就一定会得亨廷顿症吗
经典遗传学告诉我们,如果一种疾病由某个常染色体显性基因决定,那么一个人只要携带了这个基因就一定会患病。如果父母双方有一方患病,那么孩子患病的几率为50%。
具体到亨廷顿症这种公认的常染色体显性遗传病,情况却没这么简单。即使携带有HTT突变基因,其CAG重复数也存在多种可能。

当CAG 重复数在36–39 次之间,这种情况被称为不完全外显性(reduced penetrance),其特点如下:
- 有些人终身不发病,尤其是接近36的人;
- 有些人发病时间非常晚,可能在70岁后才出现症状;
- 同样的重复数,在不同人身上表现不同,可能与其他基因、环境、性别等因素有关;
- 生殖细胞中重复次数可能继续扩增,下一代的发病风险可能更高。

做过遗传咨询的人,可能听过不完全外显性这个词。其含义是具有致病基因突变的人群中,并非每个人都会发病。



也就是说,即便携带了致病基因突变,患病的概率也只是比别人高,比如60%或80%,而决定这种可能是否变成现实的则是其他因素。对于亨廷顿症,某种影响基因表达的因素会影响突变蛋白的含量及致病性,从而决定疾病是否出现以及出现时间和严重程度。近年来的研究发现,这种因素可能就是肠道菌群。
——肠道菌群与亨廷顿舞蹈症
虽然亨廷顿症的主要病理特征在大脑,并不意味着其他器官不受影响。因为突变型亨廷顿蛋白(mHTT) 并不是只在大脑中表达,而是广泛表达于人体多种组织和细胞中,只是对神经系统特别是大脑的毒性最为显著。


除了进行性运动障碍(包括舞蹈病)、认知缺陷(最终导致认知障碍)、精神异常(其中最常见的是抑郁症),亨廷顿症患者往往还有外周症状(特别是胃肠道功能障碍),经常受到慢性腹泻、便秘、食道和胃炎、意外的体重减轻、以及糖尿病易感性的困扰。
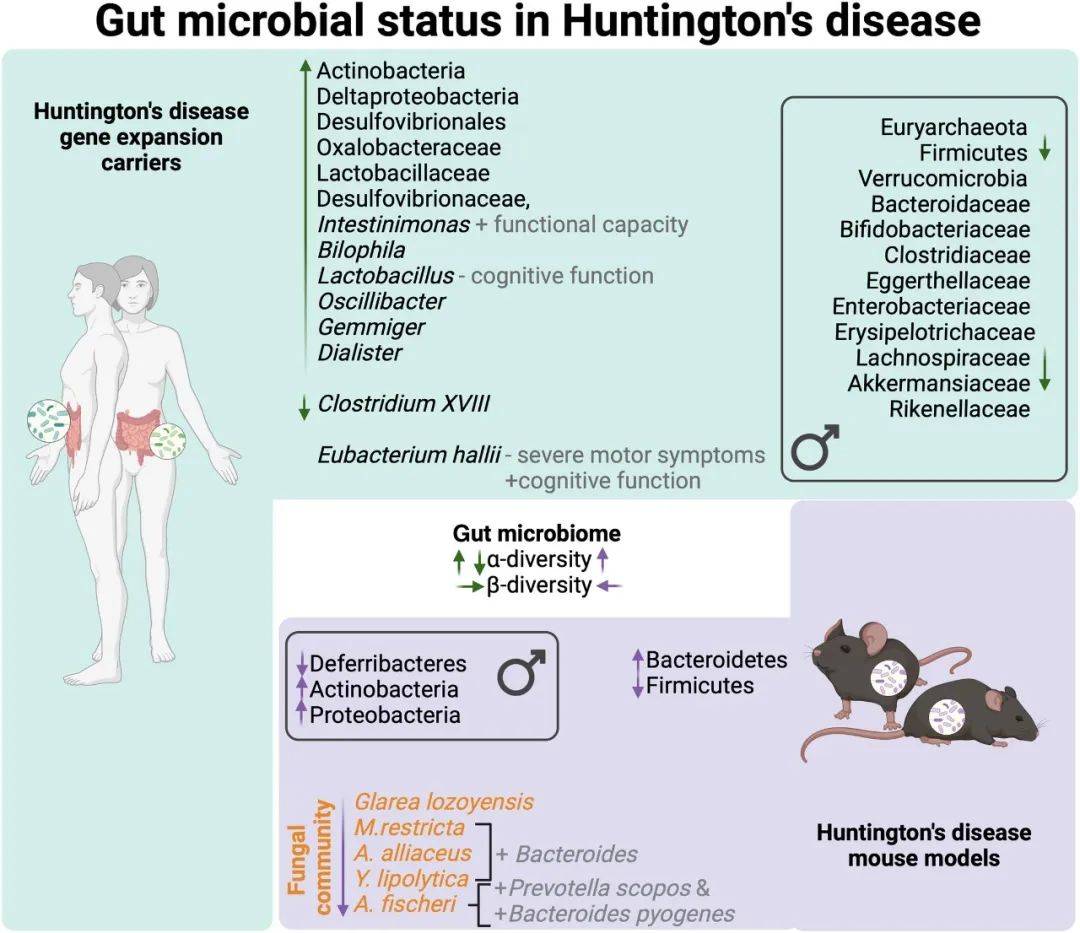
肠道菌群失调。研究发现,亨廷顿症患者的肠道菌群发生了明显改变,细菌和真菌组成都不同于健康对照组。虽然具体肠道菌群组成尚有争议,但有研究发现,患者肠道某些革兰氏阴性菌含量显著增加。【1】
特定的微生物可能在亨廷顿症中产生触发效果。用抗生素清空肠道菌群能延缓亨廷顿症模型果蝇的疾病进程,而单独定植大肠杆菌会加速mHTT聚集,诱导运动障碍并缩短寿命。醋杆菌属(另一种革兰氏阴性菌)或大肠杆菌的丰度升高也会加速亨廷顿症病理学并缩短寿命 。【2】
秀丽线虫的研究也发现,大肠杆菌和克雷伯氏菌等革兰氏阴性菌可促进毒性蛋白的扩增和聚集,进而诱发神经退行性病变。
肠漏。亨廷顿症患者和模型动物都有肠漏问题,肠道屏障渗透性明显增加,表现出与炎症性肠病相似的胃肠道损伤,甚至肠道上皮干细胞的再生都受到了mHTT的抑制。这些也是患者表现出明显体重减轻和营养吸收不良的主要原因。【3】肠漏会导致原本不应该进入血液的物质比如细菌或者细菌成分(如内毒素)入侵。
循环炎症。亨廷顿症患者和模型动物都表现出明显的先天免疫激活,其单核细胞、巨噬细胞和Th17细胞对微生物抗原(比如细菌内毒素LPS)的反应明显增强,血液中促炎症细胞因子(比如IL-6)含量显著增加。
神经炎症。小胶质细胞是中枢神经系统的主要免疫细胞,而小胶质细胞的发育、分化、成熟和正常功能都离不开肠道菌群。除了外周先天免疫激活,mHTT基因携带者的小胶质细胞在亨廷顿症神经系统症状出现前数年就呈现出过度激活状态。且这种激活与血液IL-1β、TNF-α 和 IL-6 等促炎细胞因子水平异常以及突触变性和认知能力下降相吻合。
细菌易位与脑漏。在亨廷顿症患者的死后脑组织中已经检测到真菌抗原(如白色念珠菌)和细菌DNA序列。分离的DNA测序显示,与其他神经退行性疾病相比,亨廷顿症大脑中革兰氏阴性细菌种类(如假单胞菌、不动杆菌和伯克霍尔德氏菌Burkholderia)选择性富集。
结合上述研究发现,食与心推测:HTT基因CAG重复数超过36的人,可能合成突变型亨廷顿蛋白(mHTT),而这种毒性蛋白会破环大脑神经和肠神经。但是决定身体中合成多少毒性蛋白的,除了CAG重复数,还有肠道菌群。在其他因素相同的情况下,CAG重复数越高,合成的毒性蛋白越多,就可能越早出现亨廷顿症症状,包括认知减退、舞蹈样动作、胃肠道功能障碍、情绪问题等等。
而在CAG重复数相同的情况下,肠道菌群则是决定合成多少毒性蛋白的关键。肠道菌群异常会降低肠道屏障功能,促进毒性蛋白合成,引起肠漏问题,而肠漏使得肠道中的微生物抗原进入血液,引起循环炎症和神经炎症,一些细菌或真菌还可能易位进入血液甚至穿过血脑屏障进入大脑,加速大脑损伤。而如果拥有稳定多样化的健康菌群,肠道屏障功能正常,免疫正常(先天免疫无异常激活),少量合成的毒性蛋白能被及时清除,突变基因携带者也可能晚发病(比如70岁后)或者终生不发病。
——粪菌移植对亨廷顿舞蹈症的影响
既然肠道菌群在亨廷顿症中发挥重要作用,那么把健康个体的菌群移植给患病个体,能改善症状吗?
目前还没有相关临床研究报道,不过动物研究探索了这种可能。
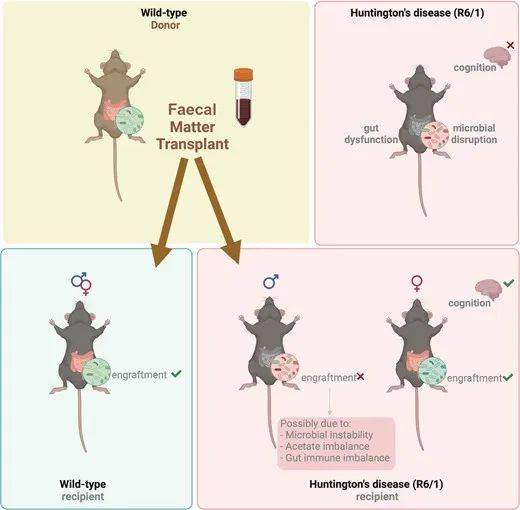
一项研究在8周龄是用混合抗生素处理清空菌群,9周龄时将同年龄和性别的野生型小鼠的粪便菌群移植给亨廷顿症模型小鼠(将人类的HTT突变基因转给小鼠),并探索了抗生素+粪菌一直对于小鼠运动能力、认知、生理和菌群等各方面的影响,在20周龄时结束实验。【4】
研究发现,从野生型到亨廷顿病小鼠的粪菌移植未能改变运动症状和最终结局,但是挽救了雌性亨廷顿症小鼠的认知能力。
进一步分析发现,粪菌移植对于认知能力的改善与菌群移植的成功与否有关。雌性亨廷顿症模型小鼠在粪菌移植后与供体菌群相似(植入成功),而雄性亨廷顿症模型小鼠中菌群并未成功植入。
推测可能与干预时机有关:雄性亨廷顿模型小鼠在8周龄时已出现明显菌群异常(肠漏)而雌性小鼠此时菌群正常。另外人类的HTT突变基因对于小鼠肠道粘液层的改变也可能有影响。
——益生菌和益生元对亨廷顿舞蹈症的效果
一项随机对照研究分析了6周益生菌干预对于HTT基因扩增携带者的影响,
研究发现,与匹配的对照组相比,HTT基因扩增携带者存在明显菌群失调。但是6周的益生菌干预没有改变菌群,对认知、情绪和胃肠道症状也没有显著影响。【5】
较短的干预时间及没有考虑饮食因素可能是没有改变的重要原因。
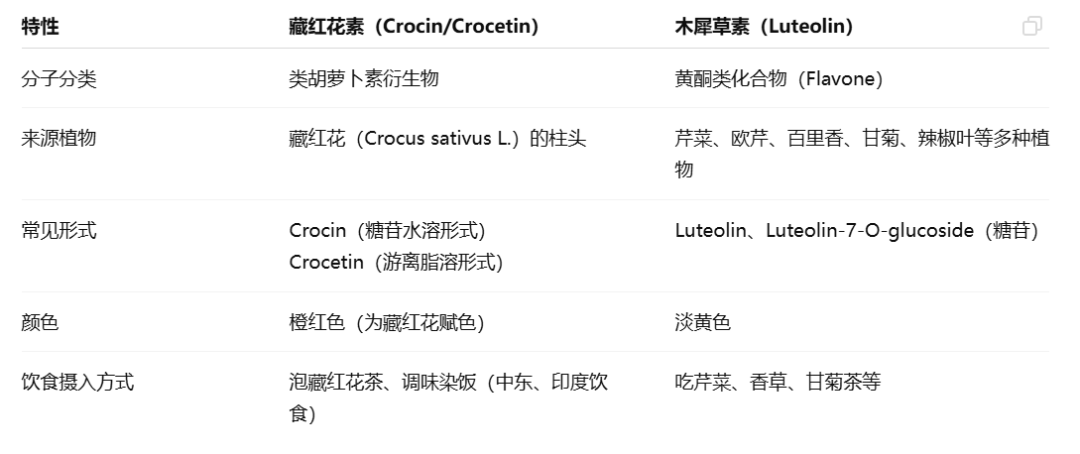
一些益生元比如木犀草素和藏红花素表现出抗氧化、抗炎、神经保护、抗癌等生物活性。
在亨廷顿症模型果蝇中,木犀草素表现出改善运动缺陷、减少mHTT蛋白聚集体、增加存活率的效果,而藏红花素的效果比木犀草素更强。【2】

——高纤维饮食对亨廷顿舞蹈症的影响
2024年的一项研究探索了高纤维饮食对于雄性 R6/1亨廷顿症(HD)模型小鼠的影响。
R6/1 HD 小鼠和野生型同窝小鼠从第6周龄开始到20周龄,随机接受含有不同纤维量的饮食:高纤维(10% 纤维)、对照(5% 纤维)或零纤维(0% 纤维)。研究者同时追踪了运动认知和情感缺陷的发生和发展,以及胃肠道功能和肠道形态变化。【6】
研究发现,与对照饮食相比,高纤维饮食改善了HD小鼠的认知能力,减少了抑郁和焦虑行为,和情感功能行为测试中的表现,并增强了HD小鼠和野生型小鼠的胃肠功能。
膳食纤维并不调节体重、水摄入量、脑体重及运动功能,也没有改变菌群α多样性,但显著改变了β多样性。
与野生型小鼠相比,高纤维饮食的R6 / 1 HD小鼠显示脱硫杆菌门和拟杆菌科、布蒂里球菌科、振孢螺科、瘤胃球菌科的相对丰度增加,放线杆菌门、弯曲杆菌门、梭杆菌门和变形菌门、弯曲杆菌门、食肉杆菌科、棒状杆菌科、Gemellaceae科、Micrococcaceae、Neisseriaceae、Selenomonaceae、Weeksellaceae和乳杆菌门的相对丰度降低。菌群功能分析(PICRUST)显示,高纤维饮食的 R6/1 HD 小鼠细菌群落中,与硝酸盐还原和蛋白质 N-糖基化相关的途径表达降低。而这些通路表达增强与包括亨廷顿症在内的多种神经退行性疾病有关。
虽然这项研究未发现短链脂肪酸的变化,但以往研究提示,肠道微生物代谢膳食纤维产生的短链脂肪酸对于增强肠道屏障功能,降低炎症水平、改善血脑屏障以及促进神经保护都具有积极影响。

食与心温馨总结:大部分人会把身体健康状况归因于基因。身体健康是因为从父母那遗传了好的基因,体弱多病/罹患某种慢性疾病则是不幸遗传了致病基因。实际上,基因决定的只是部分健康或疾病的范围可能性,现实是健康还是患病还要看第二基因组的主力军——肠道菌群。
具体到经典常染色体遗传病亨廷顿症这种神经退行性疾病,HTT基因突变导致CAG重复次数≥36此时,就可能罹患亨廷顿症,重复次数越多,患病可能性越高。大部分携带者会在成年后患病,但也有人携带这个基因而终生不患病,也有人延滞到70岁以后才患病。
看来尽管携带HTT突变基因决定了这种遗传病的患病风险,但具体是否患病,什么年龄患病,肠道菌群说了算。
从HTT突变基因编码的毒性蛋白不仅会损害大脑和神经系统,也会影响肠道屏障、肠神经系统和迷走神经的角度来看,对于今天高速暴增的秽语抽动症来做一审视,是不是也存在着某种重复序列在制作着超越自己抑制能力的蛋白?不久科学家会给出答案。因为秽语抽动症也非常容易通过第二基因组的供体——肠道微生物和饮食来进行有效干预。
异常基因携带者往往在有明显亨廷顿症状之前就已经表现出肠道菌群异常,而异常菌群会损害肠道屏障功能,增加肠道屏障渗透性(肠漏),此时一些原本只应该待在肠腔内的微生物(如细菌或真菌)或抗原(如革兰氏阴性菌产生的内毒素)会进入血液;引起循环炎症水平升高,血脑屏障渗透性增加(脑漏),微生物/微生物抗原+毒性蛋白会造成大脑炎症和神经细胞凋亡。外在表现则是异常的行为(非自主的舞蹈样动作)、认知减退、情绪障碍等亨廷顿症状。同理,秽语抽动症那种不由自主的表现也与神经系统受到某种干扰,或者脂肪酸代谢异常导致神经髓鞘不能正常生成有密切关系。
而如果能在肠漏发生前就调整肠道菌群,修复肠道屏障,则可能防治疾病。在肠漏后干预也可能延缓疾病进程,改善症状。
虽然目前粪菌移植干预和益生菌干预的研究改善并不明显,但饮食干预的效果却非常令人振奋。对于携带HTT突变基因的小鼠,高纤维饮食能增强胃肠道功能,调整肠道菌群,减少了亨廷顿症相关的认知减退和情感障碍。
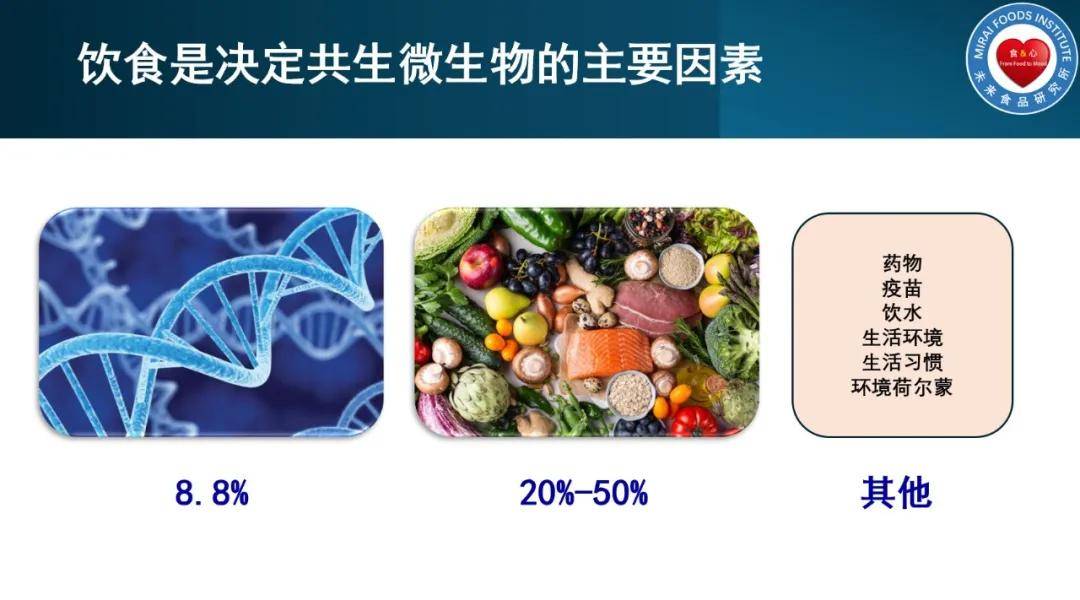
这也与之前的发现一致,宿主自身遗传基因对于肠道菌群的影响力仅为8.8%,而饮食的影响力可达20-50%。如果能将粪菌移植或者益生菌/益生元干预与饮食干预结合起来,对于菌群的调整效果会更加明显。
从寥寥无几的亨廷顿症这样有明确致病基因的遗传病看来,即便检测到的所谓易感基因对疾病的影响也远远小于亨廷顿自身突变基因。在这种情况下,通过健康的饮食调整好肠道菌群和肠道屏障,将疾病发生的可能性降到0或者80岁后完全有可能。
最后再次强调,这项研究的介绍并不是只写给极端稀少的亨廷顿症患者,而是告诉大家任何情况下相信第二基因组有想象不到的能力帮助我们免于各种疾病,或者带我们从疾病困境中出来。人类的基因组有30亿以上的核苷酸排列,其中的类似亨廷顿舞蹈症这种三核苷酸重复的情况非常多,过多的情况下常被称为脆性位点(fragile sites),这些问题是否真的让生命质量下降,看来第二基因组还有话要说。我们在任何问题面前,可以多多考虑自己的肠道微生物是否能帮上忙。
参考材料
1. https://journals.sagepub.com/doi/full/10.3233/JHD-240012#ref030
2. https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2022.902205/full
3. https://febs.onlinelibrary.wiley.com/doi/full/10.1111/febs.17102
4. https://academic.oup.com/braincomms/article/4/4/fcac205/6661439
5. https://journals.sagepub.com/doi/abs/10.3233/JHD-220556
6. https://www.sciencedirect.com/science/article/abs/pii/S0889159123004051
