《细胞》:有些细胞能自行排毒!为阿尔茨海默病治疗提供新思路
阿尔茨海默病(AD)、额颞叶痴呆等神经退行性疾病存在一个共同特征: 大脑中的tau蛋白会出现异常缠结,并形成有毒的聚集体。这些聚集体会持续破坏神经元,造成细胞死亡,导致患者出现认知功能障碍。
不过,在过往的一些分析中,科学家们注意到并非所有的神经元都对毒性tau蛋白敏感,有些神经元能很好地应对tau蛋白,并且存活下来。而挖掘出这类神经元的天然优势,或许能帮助我们更好地应对AD的发生与发展。
在最新的《细胞》杂志上,加州大学洛杉矶分校的研究人员发现了一类特殊的 CRL5-SOCS4蛋白复合物, 它能够标记tau蛋白并推动降解过程。而增强这种天然防御机制或能有效减少毒性tau蛋白的形成与累积。此外,研究还发现 氧化应激在影响线粒体后,会削弱细胞的tau蛋白清除能力。这些发现有望为治疗AD提供新的启示。

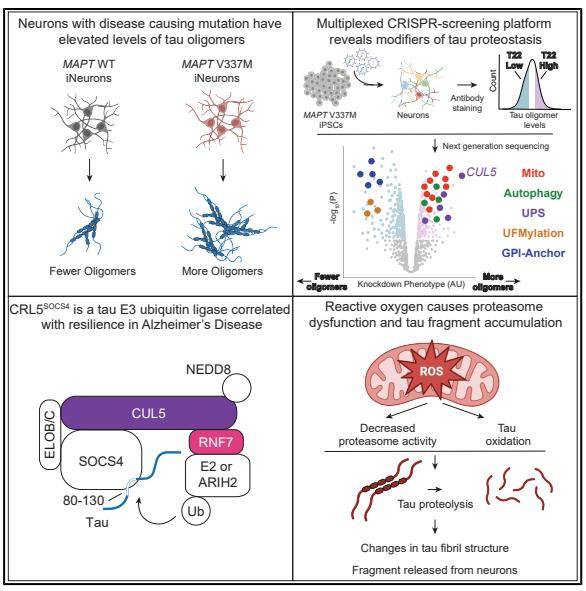
研究中,作者借助人类诱导多能干细胞(iPSC)培养了一批神经元,但他们让其中部分细胞携带了特定基因突变,会导致细胞更容易聚集毒性tau蛋白。同时,研究者还构建了一个大型的筛选文库,他们主要想找到哪些基因的变化能够影响神经元内tau蛋白的累积。
分析确认了之前已知的自噬、泛素-蛋白酶体系统对tau蛋白具有调控作用,还找到了一个全新的调控基因CUL5。它编码的蛋白CUL5可以作为核心骨架,并搭建泛素酶、底物接头蛋白形成特殊蛋白复合物。
分析显示,基于此构建的CRL5-SOCS4复合物具备特异性tau调节能力,它主要可以将泛素分子连接到tau蛋白上,并推动其前往蛋白酶体降解。如果降低CUL5的表达水平,会导致神经元细胞内的tau蛋白水平升高。
研究人员进一步分析了来源于AD患者的组织样本,他们发现尽管AD会伴随大量神经元死亡和丢失,但仍有一些神经元保持了高度韧性——而这些细胞的CUL5表达远远要更高。
▲研究示意图(图片来源:参考资料[1])
另外,研究还揭示了线粒体功能障碍与tau蛋白毒性之间意想不到的联系。当研究人员破坏线粒体时,他们触发了一种特定tau蛋白片段的产生,该片段的大小约为25千道尔顿。这种片段与在AD患者的血液和脑脊液中发现的一种生物标志物—— NTA-tau非常相似。这种异常的tau片段会改变tau蛋白的聚集方式,从而可能影响疾病的进展。
研究者指出,异常tau蛋白片段很可能是在细胞经历氧化应激时产生的。而氧化应激在衰老和神经退行性疾病中很常见,它会降低蛋白酶体的效率,导致其无法正确处理tau蛋白。
这些发现为AD治疗方法的开发提供了潜在线索。例如增强CRL5-SOCS4活性可能有助于神经元更有效地清除tau蛋白,而维持应激期间蛋白酶体功能则可以预防有毒tau蛋白片段的形成。
参考资料:
[1] CRISPR screens in iPSC-derived neurons reveal principles of tau proteostasis. Cell (2026). DOI: 10.1016/j.cell.2025.12.038
