《Nature》最新公布 | 为什么调理肠道菌群可以缓解抑郁与焦虑
传统精神疾病治疗方案通常包括抗抑郁药、抗精神病药物、心理治疗和电休克疗法。然而,近年来,一个意想不到的领域正在精神病学界引起广泛关注——肠道及其微生物群落。菌群移植(FMT)正从消化科转向精神科,为那些对传统治疗无效的精神疾病患者带来新的希望。
2025年8月18日,国际权威杂志《Nature》Outlook栏目发表了题为《Why nurturing the gut microbiota could resolve depression and anxiety》的深度文章,系统探讨了肠道微生物群与精神健康之间的密切联系,以及基于微生物组的干预策略如何可能改善抑郁和焦虑等情绪障碍。

从动物研究到临床试验:证实肠道菌群与情绪相关联
2016年爱尔兰科克大学学院的神经生物学家John Cryan及其同事发现,抑郁症患者的微生物群落与健康人存在显著差异。为证明因果关系,他们将这些微生物群移植给健康大鼠,接受移植的大鼠表现出无欲感(缺乏兴趣和愉悦)和类似焦虑的行为,并且改变了色氨酸的代谢。同一时期,由中国重庆医科大学的研究人员领导的小鼠实验也表明了相同的结果。
这些研究启发了泰勒和她的同事们,“我们在想,如果可以这样转移疾病,那么是否可以反过来治疗疾病呢?”泰勒说。
于是她们开启了一项针对在现有药物中效果并不显著的临床抑郁症患者的试验。通过微生物群移植技术(FMT),即将健康供体的粪便被转移到受体的胃肠道中,以恢复肠道细菌的健康平衡。
其中,Andrew Moseson的效果尤为明显,他多年来饱受严重抑郁症困扰。“有些日子我根本无法起床。经历了长期失业,一度只能住在车里。”他尝试过药物、运动、志愿服务、迷幻药,阅读了大量关于幸福和抑郁的书籍,“每样都有点帮助,但抑郁始终如影随形。”
但在接受FMT后,一周内他开始感觉好转。“我觉得我的大脑仿佛被刷新了,”Moseson表示。两年后,虽然他仍在服用抗抑郁药,但“移植可能增强了抗抑郁药的效果”,无论机制如何,变化是明显的:“我感觉自己已经痊愈。”
Moseson 和其他类似的经历提供了初步证据,表明基于微生物群的治疗可能对抑郁症和焦虑症等情绪障碍患者有益。

Valerie Taylor是加拿大卡尔加里大学的一名精神病学家,她正在研究精神疾病如何影响肠道菌群。图片来源:卡尔加里大学
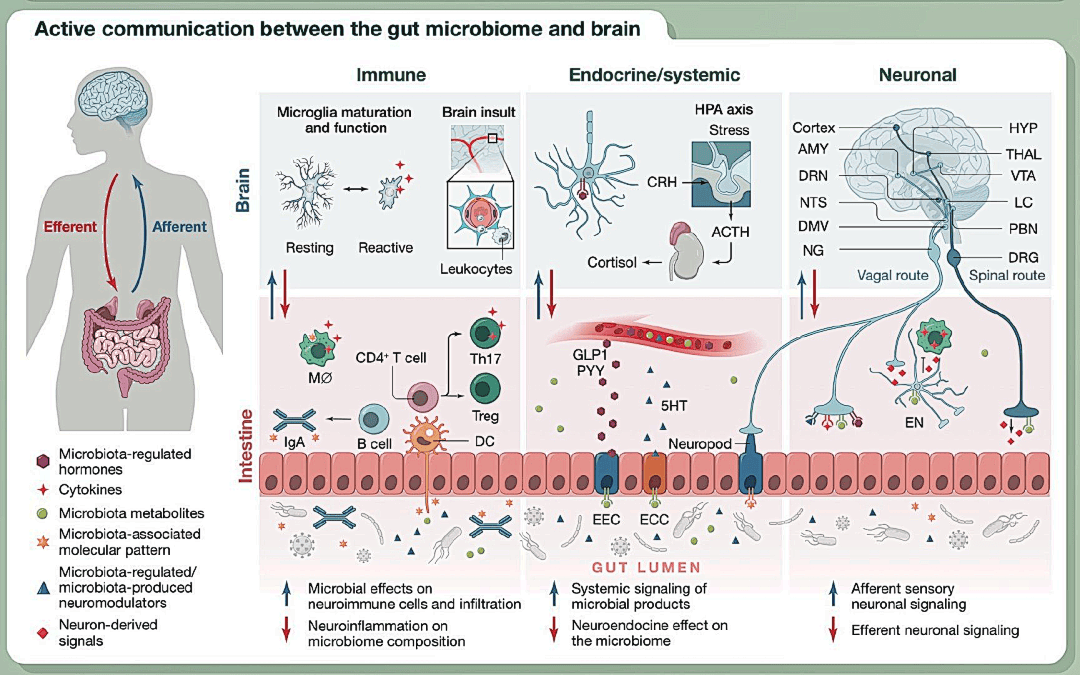
机制阐释:肠脑轴的多通路通信
这些研究表明,肠道和大脑之间存在双向交流途径,大致可分为四大类。
- 免疫调节:菌群失衡可异常激活免疫系统,增加炎症因子释放,进而影响大脑功能,诱发或加重抑郁、焦虑等精神疾病。
- HPA轴调控:其紊乱会干扰HPA轴功能,导致皮质醇等应激激素分泌异常,长期异常会对大脑结构与功能产生负面影响。
- 迷走神经通路:菌群变化可影响肠神经系统,并通过迷走神经(连接肠与脑的关键神经通路)将信号上传至大脑,从而调控情绪与大脑功能。
- 代谢物作用:微生物产生的代谢物(如短链脂肪酸SCFAs)可通过肠神经系统发挥作用,或进入血液、穿过血脑屏障直接影响大脑,亦可影响神经递质和生长因子等分子的合成。
肠道菌群通过免疫系统、HPA 轴、迷走神经及代谢物这四大途径,构建起肠道与大脑的双向交流网络。这些途径相互作用,共同影响着大脑功能与情绪状态,其紊乱可能成为抑郁、焦虑等精神疾病的重要诱因,也为基于肠道菌群的精神疾病干预提供了关键的机制依据。
AI探索:菌群与疾病的关联公式
菌群移植在精神疾病领域的研究尚未大规模开展,多数发现也尚未在大型临床队列中得到验证,这在一定程度上制约了相关研究的推进。
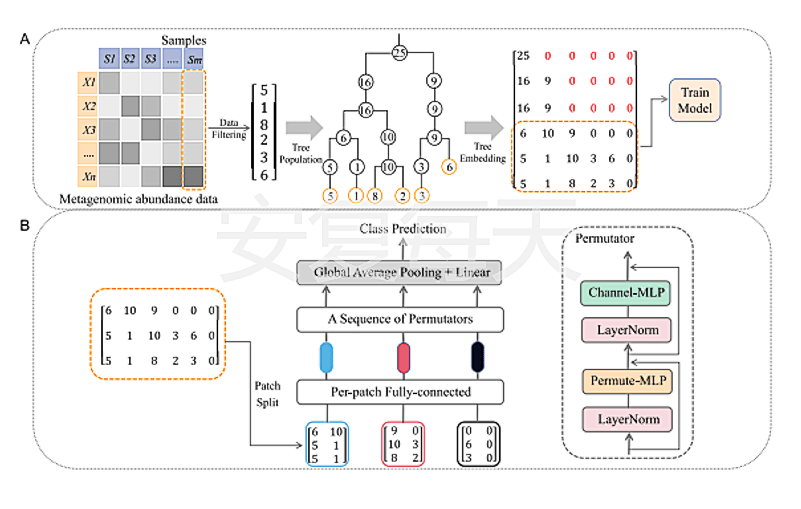
在此背景下,君常怡生物联合深圳大学大数据系统计算技术国家工程实验室共同完成了基于宏基因组排列器(MetaP)开发的疾病预测模型,有效解决了样本量有限、高维度以及数据稀疏性等困扰相关研究的难题,并发表于于Springer Nature旗下期刊BMC Bioinformatics。
文章提到MetaP受到了Permutable MLP-like架构在视觉识别领域成功应用的启发,将这种先进的网络结构应用于宏基因组数据分析。通过利用系统发育树结构,MetaP能够将宏基因组丰度数据转换为二维矩阵,进而捕捉到微生物之间的系统发育信息。这个创新性的方法不仅显著提升了分类性能,还在多分类任务和大样本量的情况下展现出更高的准确率。
MetaP不仅在性能上优于其他深度神经网络和传统机器学习方法,还提供了对模型预测的深刻解释。我们采用了SHAP(SHapley Additive exPlanations)方法,成功识别出与疾病相关的关键微生物特征,为理解疾病机制提供了宝贵的线索。MetaP,它不仅是研究微生物与健康关系的有力工具,还为精准医学的发展带来了广阔前景。
此外,君常怡生物在精神疾病领土也拥有多项临床,其中包括抑郁症、儿童孤独症(自闭症),当前在开展临床机构合作包括国家精神心理疾病临床医学研究中心等。