BRAF V600E结直肠癌靶向治疗后寡转移,或与TP53共突变和拷贝数变异有关
背 景
转移性结直肠癌(mCRC)的治疗因临床和分子特征认识的深化而逐年改变。BRAF V600E突变存在于高达 10% 的患者中,该突变诱导BRAF激酶持续活化,致使其下游通路上调,从而增加肿瘤生长、侵袭性及转移风险。BRAF V600E突变与不良预后及标准治疗反应受限相关。在此背景下,BRAF抑制剂康奈非尼(encorafenib,恩考芬尼)联合抗EGFR药物西妥昔单抗的治疗方案显著改善了BRAF V600E突变mCRC患者的临床结局,该方案因此获批成为二线或三线治疗的标准方案(SoC)。当前研究正在探索其一线治疗应用,虽尚未获批成为该治疗场景的标准方案,但已显示出积极疗效。尽管如此,BRAF V600E突变结直肠癌的治疗仍存诸多悬而未决的问题。首要问题在于靶向治疗进展后的后续治疗方案证据有限。此外,关于BRAF V600E突变患者接受局部区域治疗的数据存在矛盾。为此,本文报告一例携带BRAF V600E突变的转移性结直肠癌患者,其出现非典型的早期腋窝淋巴结孤立性复发,并通过多学科联合方案进行治疗。通过对连续组织样本进行分子评估及全面基因组分析(CGP),旨在探究继发性耐药产生的潜在机制。
病 例
患者女,68 岁,因腹痛于 2022 年 6 月接受结肠镜检查,发现升结肠内新生物占据管腔三分之二。基线CT扫描未显示远处转移证据。遂于同年 8 月实施腹腔镜右半结肠切除术。组织病理学检查确认为低分化腺癌,分期为pT4a pN2b(19/38 枚淋巴结转移),错配修复功能完整(pMMR)(图1)。研究人员建议患者接受 6 个月辅助治疗。2022 年 10 月至 11 月期间完成 2 个周期CAPOX方案化疗,后因出现 3 级恶心呕吐提前中断治疗。2022 年 12 月起进入随访观察阶段。
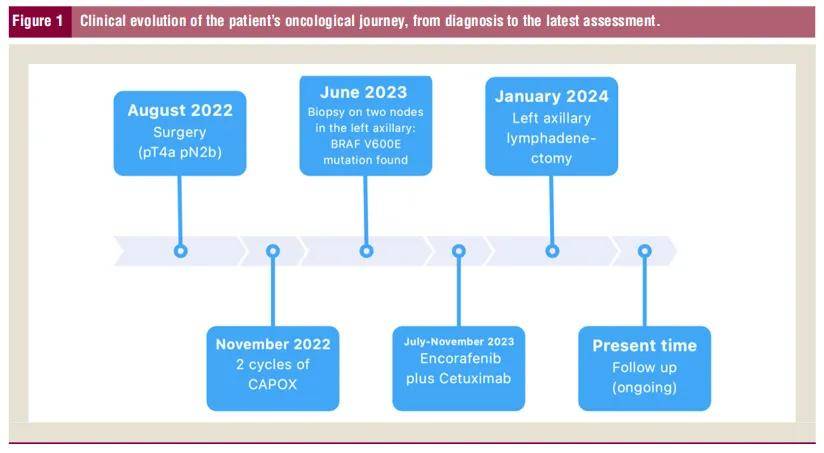
▲图1 患者肿瘤演变和最新结果
2023 年 5 月体检发现左侧腋窝区域存在两处可疑结节。超声检查证实左腋窝区域存在一枚 15×12×16 mm的异常淋巴结,其特征包括高回声结构及不规则血管分布。2023 年 6 月行活检(图2),组织学检查显示为符合结肠原发性的腺癌转移灶(免疫组化:SATB2、CDX-2及细胞角蛋白20阳性;细胞角蛋白5/6、细胞角蛋白7、TTF-1、雌激素受体、孕激素受体、Her-2/neu均阴性)。通过二代测序技术(NGS)对原发肿瘤及淋巴结转移灶的福尔马林固定石蜡包埋(FFPE)样本进行分子评估。结果显示:原发灶与转移灶均存在BRAF V600E突变(变异丰度[VAF]分别为 36% 和 14%,样本肿瘤细胞占比分别为 60% 和 20%-40%)及TP53 c.733G>A p.Gly245Ser突变,未检出其他基因变异。

▲图2 患者CT影像
基于患者早期复发、初诊分期(pT4aN2b)、辅助化疗中断(仅完成 2 个周期)及BRAF V600E突变等分子特征,排除了局部治疗作为首选方案。2023 年 7 月至 11 月期间,患者接受康奈非尼(恩考芬尼)联合西妥昔单抗靶向治疗,耐受性良好,最佳疗效评估为疾病稳定(RECIST v1.1),临床观察到病灶明显缩小。然而后续CT扫描显示疾病进展,PET/CT证实左侧腋窝区域存在高代谢腺病。该病例经IEO多学科团队讨论,综合患者化疗耐受性有限及寡转移灶可切除的特点,建议行根治性手术。2024 年 1 月,患者接受左腋窝淋巴结清扫术,组织病理学证实 11 至 15 枚淋巴结存在肠源性癌转移灶。通过对福尔马林固定石蜡包埋(FFPE)标本进行二代测序评估,确认存在BRAF V600E突变(VAF 77%,肿瘤细胞占比 60%)和TP53突变;同时新检出多个拷贝数获得(CNG)变异:包括MYC(8号染色体)、IGF1R(15号染色体)、ESR1(6号染色体)、CDKN2A(9号染色体)、FGFR2(10号染色体)的扩增,以及PTCH1基因意义未明的错义变异(c.3664G>A)。术后CT扫描显示未见疾病迹象。经与患者讨论术后辅助治疗与观察随访的潜在获益后,最终选择采取严密随访方案,每 3 个月进行一次CT扫描。术后 11 个月随访至今,仍持续进行中,未发现局部及远端复发迹象。
讨 论
尽管康奈非尼(恩考芬尼)联合西妥昔单抗的治疗方案对BRAF V600E突变型转移性结直肠癌(mCRC)具有"颠覆性革命"意义,但多数患者仍会在治疗 4-6 个月后出现疾病进展。迄今为止,支持靶向治疗耐药分子机制的证据仍显不足。BEACON试验的预设生物标志物分析通过ctDNA基因检测技术,对治疗基线期与治疗结束期的配对样本进行检测,系统研究了获得性突变谱系,并将基因变异分类为持续存在型、消失型及新获得型。结果显示:在所有治疗组中,BRAF V600E突变基本持续存在;最常见的获得性耐药相关变异包括MAPK通路突变(KRAS、NRAS、MAP2K1)及MET基因扩增;同时观察到KRAS、BRAF和IGF1R基因变异的低频出现。这些发现与文献数据高度吻合。Kopetz等人的回顾性分析表明,未出现上述获得性突变的患者生存期显著延长。该生物标志物分析为BRAF抑制剂联合抗EGFR治疗BRAF V600E突变型mCRC患者中的适应性突变能力提供了重要证据。
基线期细胞周期相关基因表达在出现关键耐药性变异患者中的富集现象表明,肿瘤增殖活性增强与耐药突变的积累存在关联。此外,观察到的SBS17a/b突变特征与获得性变异之间的相关性,揭示了这些突变过程在驱动靶向治疗耐药性中的关键作用,这为制定缓解耐药性策略提供了重要科学依据。在本病例中,对唯一疾病进展部位(腋窝淋巴结)的分子分析未发现前述任何耐药相关基因变异。尽管纵向液体活检可追踪治疗过程中的克隆演化动态,但此类检测在意大利尚未纳入医保覆盖范围,临床实践中也未常规开展。鉴于本例转移灶为单发病灶,组织活检样本或能较好地代表肿瘤异质性特征。此外,通过连续获取的系列标本(原发灶、转移灶、术后复发灶),研究人员成功实现了肿瘤分子频谱的动态监测。
本病例分析揭示了一种潜在的靶向治疗耐药新机制:除已知变异外,TP53共突变伴随多发性非连续基因组区域的拷贝数变异(CNVs)。TP53功能缺失通过促进染色体不稳定性(CIN)耐受和增加体细胞拷贝数变异(SCNA)多样性,在酪氨酸激酶抑制剂(TKI)耐药克隆形成中起关键作用。这种基因组不稳定性使肿瘤能够在TKI治疗的选择压力下实现适应性进化。值得注意的是,基于液体活检的全面基因组分析(CGP)在检测CNVs时存在局限——尤其对于无肝转移且ctDNA释放量低的病例。分子监测发现BRAF V600E变异等位基因频率(VAF)较基线显著升高(77% vs 36%;肿瘤细胞占比 60% vs 20-40%)。这与Ros等人研究一致:高VAF预示肿瘤侵袭性增强,与BRAF V600E突变型mCRC患者较差的无进展生存期(PFS)和总生存期(OS)相关。此外,突变型BRAF等位基因的扩增已被确认为BRAF V600E突变型mCRC和黑色素瘤中对RAF/MEK抑制剂的耐药机制。但VAF动态变化对克隆演化的预测价值仍需深入探究。另一潜在耐药机制涉及IGF1R过表达,该现象可能导致靶向治疗失效。当前众多研究者正深入真实临床环境探索治疗耐药性的潜在突变机制。新近数据与Kopetz的研究结果相印证,强化了RAS基因在驱动耐药机制中的关键作用。迄今为止,大量临床研究致力于界定康奈非尼(恩考芬尼)联合西妥昔单抗治疗失败后的特定治疗路径,聚焦于潜在治疗靶点的抑制剂开发。对于仅存在肝/肺局限性转移的结直肠癌患者,手术切除因其可能实现长期无进展生存期(PFS)和总生存期(OS)仍是标准治疗。相反,针对淋巴结或骨转移等其他类型转移患者,靶向转移灶的治疗疗效与价值仍存争议。目前个案报道中偶见BRAF突变型转移性结直肠癌根治性手术或其他局部干预手段(如立体定向消融放疗SBRT)的应用,数据显示淋巴结转移患者较内脏转移者PFS与OS获益更显著。尽管如此,现行策略仍以患者为中心,需经多学科团队制定个体化决策。本案例中,手术干预寡进展病灶具有合理性,旨在实现持续超 11 个月(随访中)的无疾病状态。本研究提示:在严格筛选的病例中,手术治疗不应被预先排除。
结 论
随着BRAF靶向治疗日益前移至一线治疗方案,制定明确的疾病进展管理指南至关重要。本病例进一步证实:对于接受康奈非尼(恩考芬尼)联合西妥昔单抗治疗后进展的BRAF V600E突变型转移性结直肠癌(mCRC),局部区域治疗仍具潜在临床价值。同时,本研究探索了靶向治疗的潜在耐药机制。这些发现应视为假设性结论,需进一步验证。
我司实体瘤1299基因检测、实体瘤272基因检测PLUS、肠癌129基因检测、结直肠癌个体化治疗检测套餐、结直肠癌靶向17基因+MSI检测项目均包含BRAF V600E和TP53突变,助力精准诊疗。
参考文献:
Marsicano RM, Boscolo Bielo L, Rocco EG, Lombardi M, Bertani E, Bassi FM, Curigliano G, Ciardiello D, Fazio N, Zampino MG. Treatment of Oligometastatic BRAFV600E Mutant Colorectal Cancer: Learning From a Clinical Case. Clin Colorectal Cancer. 2025 Mar 25:S1533-0028(25)00030-1. doi: 10.1016/j.clcc.2025.03.003. Epub ahead of print. PMID: 40240266.
